摘要
作者:Wolfgang Becker, Julius Heitz, Lukas Braun, Axel Bergmann, Becker & Hickl GmbH
FLIM图像的Z-Stack扫描通常仅记录有限数量的Z轴平面和X和y上有限数量的像素。由于光诱导荧光参数的变化甚至样品中的光损伤,无法记录更高的空间分辨率。然而,对样品曝光的详细观察表明,对于Z-Stack扫描较大的物体,如小型生物或组织样本,这并不一定正确。在这里,我们展示了一个物体的高分辨率Z-Stack成像,x20显微镜镜头填充的视野是TCSPC FLIM系统的范围内的。利用Becker & Hickl DCS-120共聚焦FLIM系统的现有功能,我们演示了家蝇(Musca domestica)的Z-Stack成像,该成像具有289个Z轴层切平面,Z阶跃宽度为2.5µm, x和Y方向为1024 x 1024像素,时间上为1024通道。利用Becker & Hickl SPCImage NG的批处理函数进行双指数衰减分析。ImageJ / FIJI基于SPCImage结果进行三维重建。
研究背景
记录Z-Stack图像,或“Z轴扫描”已经很早就被引入共聚焦和多光子激光扫描显微镜[7]。显微镜扫描一个图像平面,保存图像数据,改变焦点深度,扫描另一个平面。该过程继续进行,直到所需的平面数量已被扫描,见图1。理想情况下,足够多的紧密间隔的z平面将被扫描,以允许重建样品的三维结构。
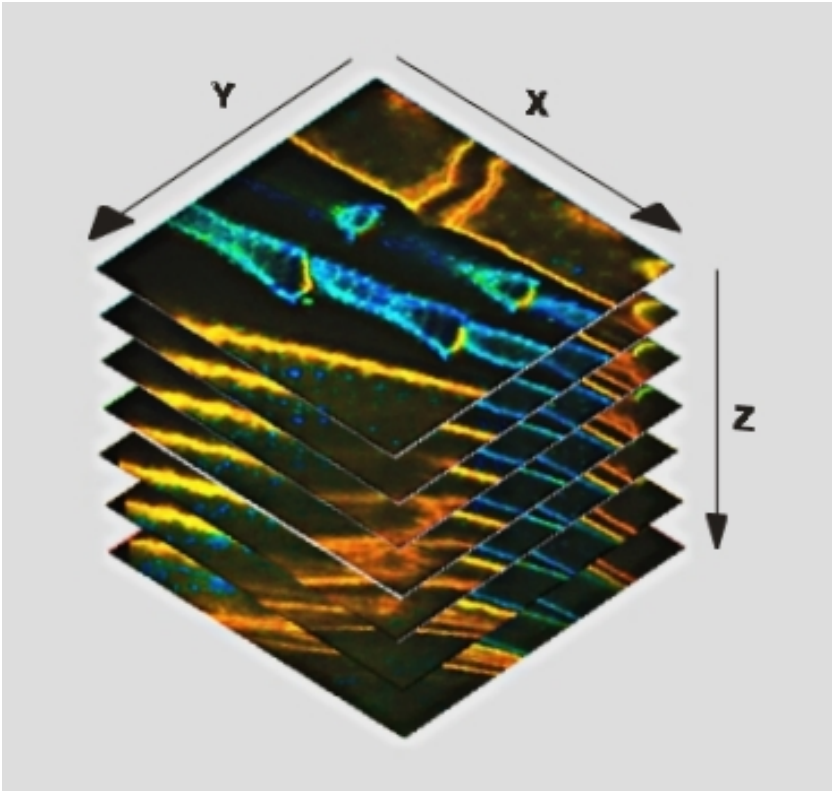
图1:Z-Stack记录原理
FLIM系统
实验
“寿命+强度”意味着每像素的光子数量由并行快速计数器决定,从而避免了在高计数率下的非线性强度尺度[1,5]。289个测量周期被执行,每个周期被“自动保存”功能保存。文件名为“Musca-c0001”到“Musca-c0289”(图2左)。显微镜的控制参数如图2右二所示。通过这些设置,DCS-120系统在显微镜的绝对Z尺度上记录6047µm至6767µm的289个平面。Z轴步长为2.5µm。单个平面的扫描格式为1024 × 1024像素,1024个时间通道(图2,右)。
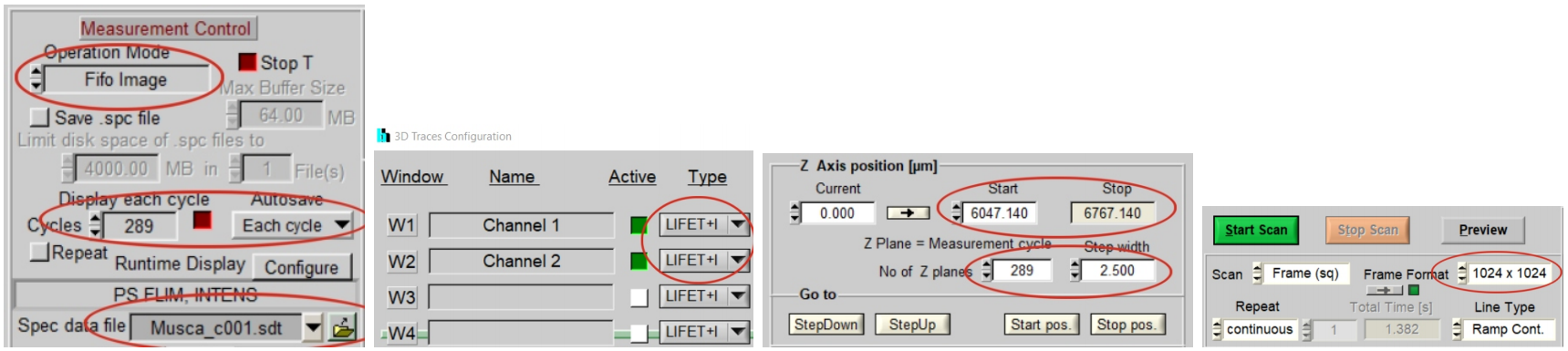
图2:FLIM系统的基本系统参数
测量对象为一只家蝇(家蝇,采自窗台,无需伦理审批)。激发波长为405 nm,样品平面内的激发功率约为100µW。每个平面的捕获时间为60秒。探测光路采用450nm的长通荧光滤光片。显微镜镜头为蔡司EC PLAN-NEO Fluar, M=20, NA=0.5。
实验结果
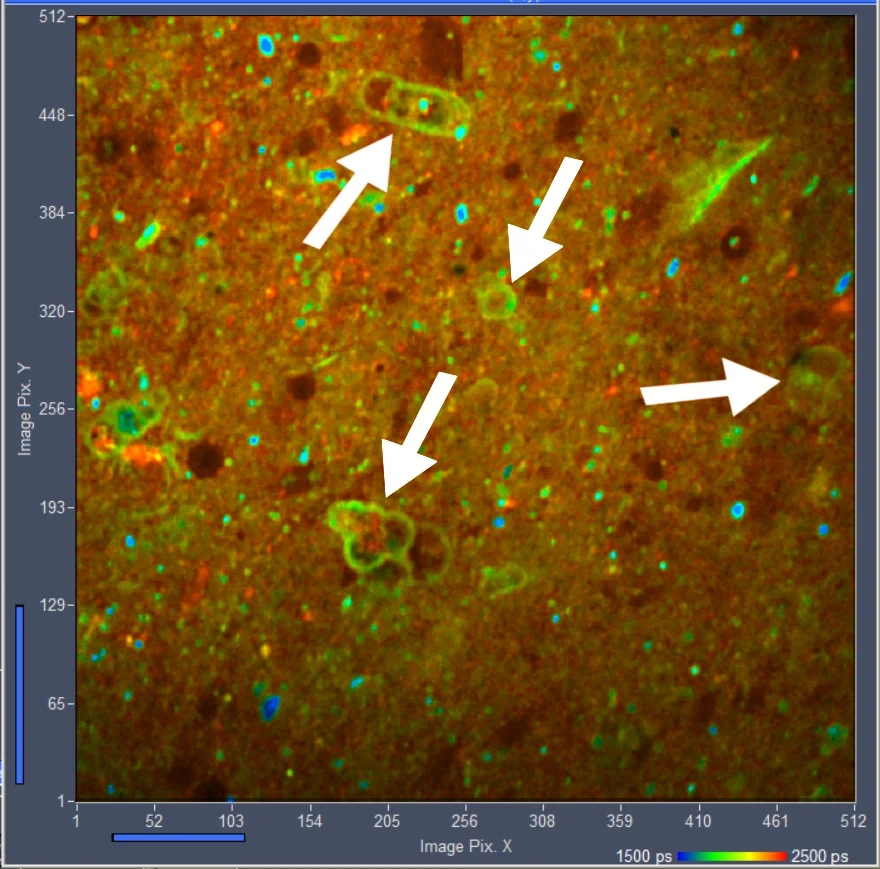
图3显示了从记录的289个平面中选择的三个平面的图像。通过SPCM的“Multi-File”视图选择图像。颜色表示寿命,由SPCM的在线寿命显示功能计算[1]。
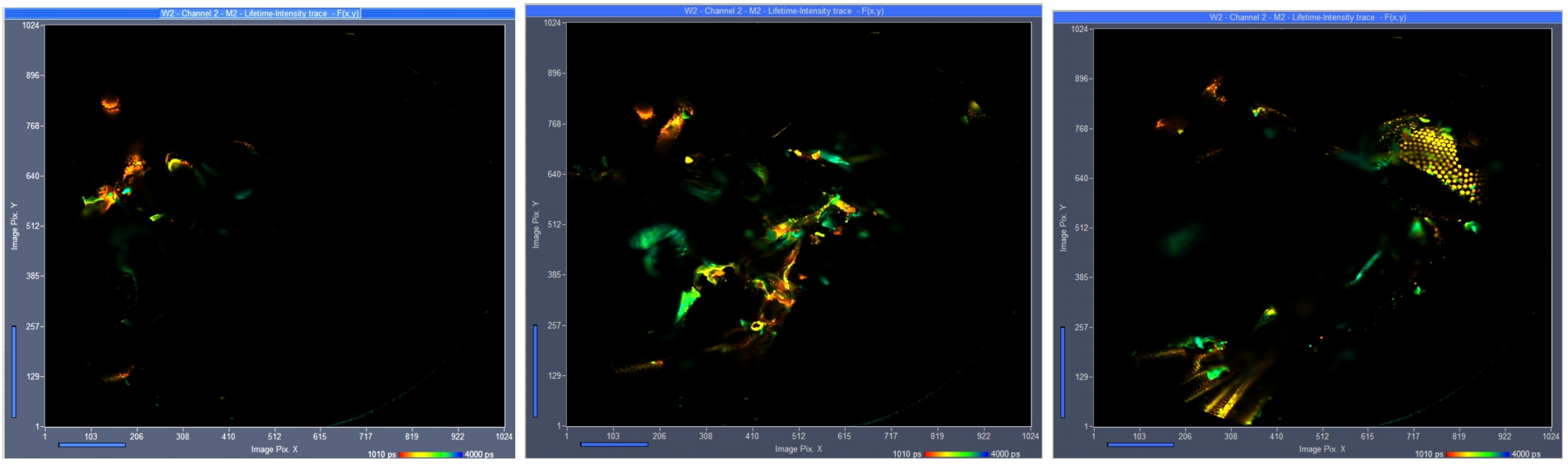
图3:不同Z平面的三幅图像。从左到右:平面120,平面150,平面180。SPCM的在线寿命功能。
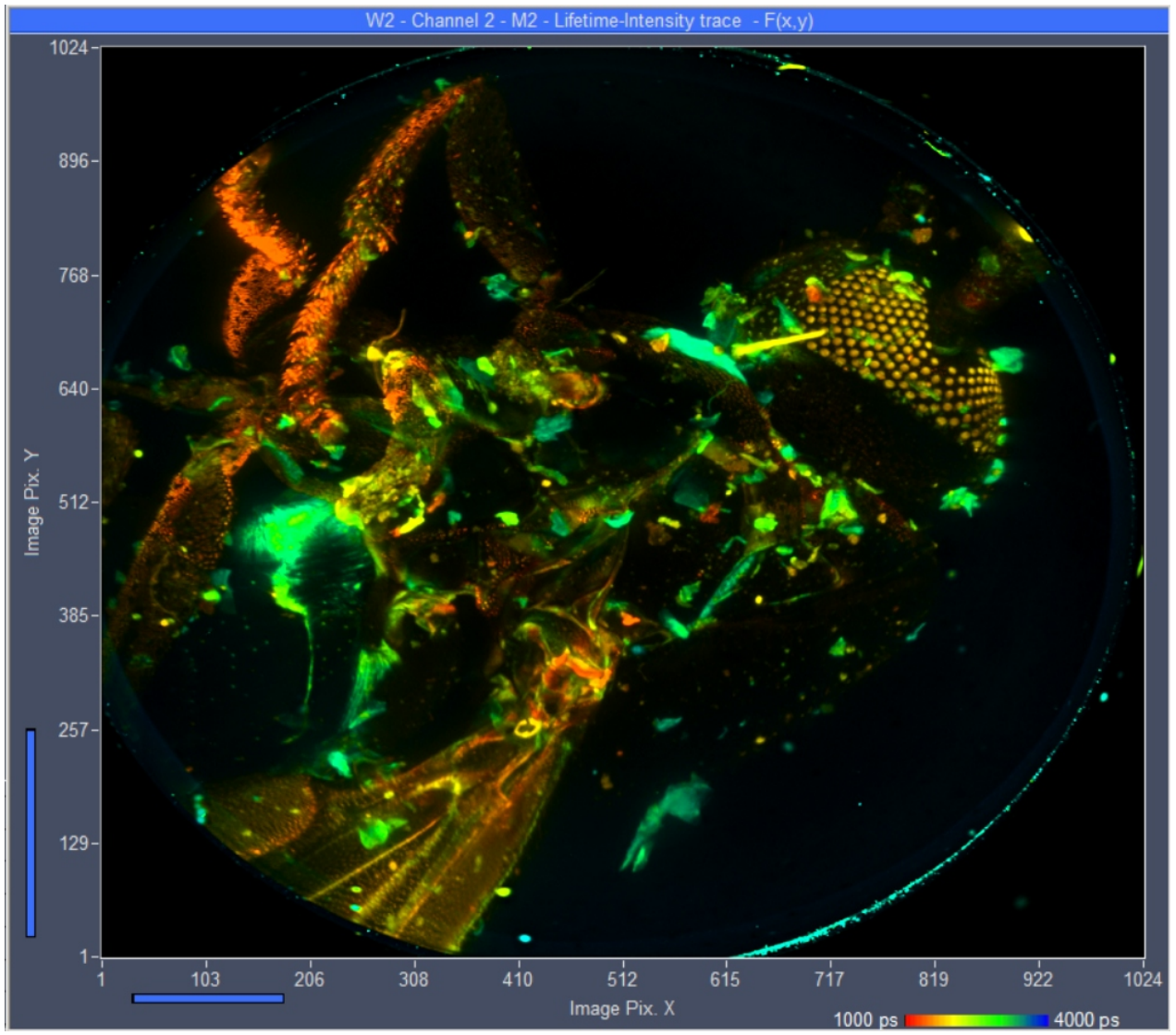
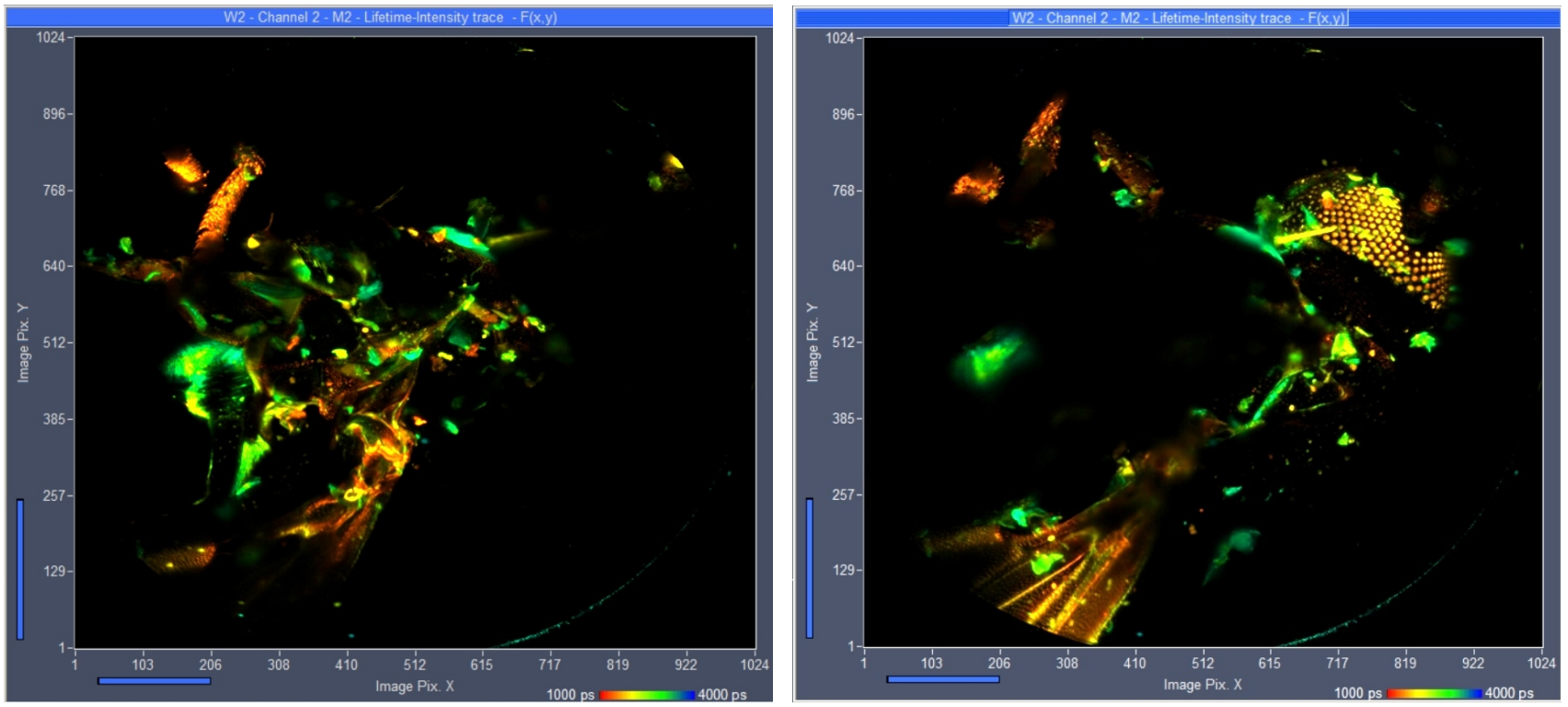
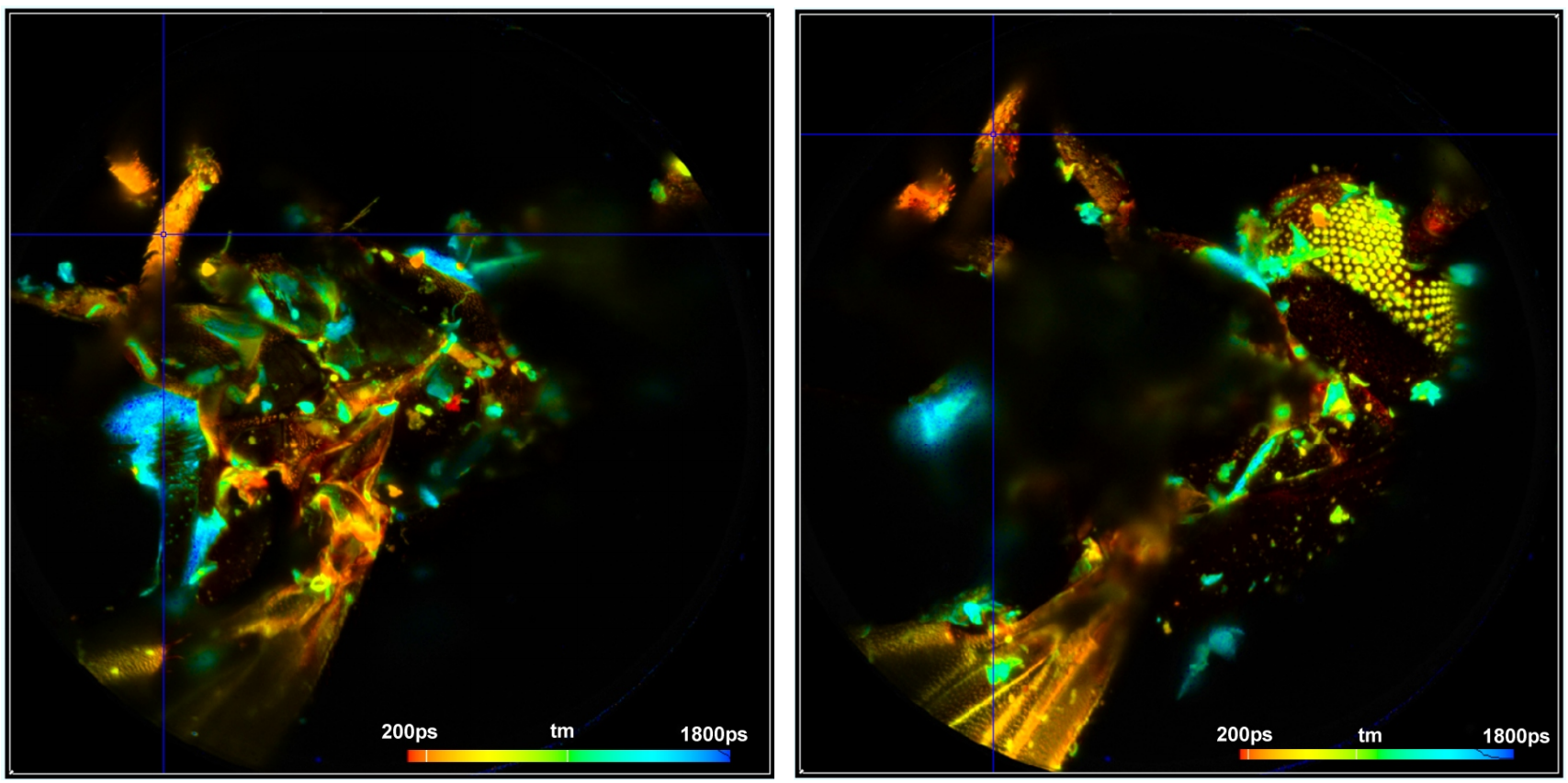
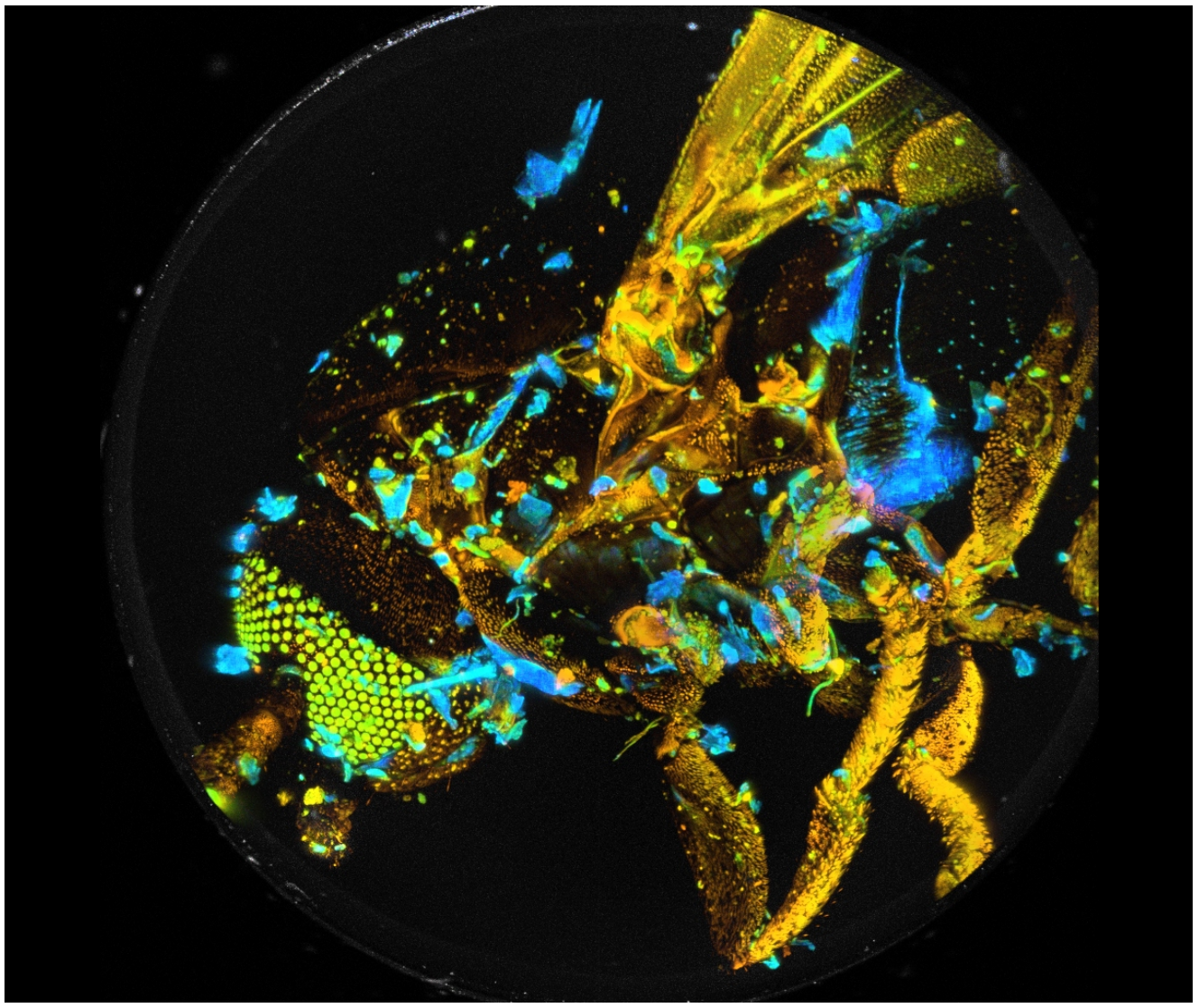
Image J三维图像重建

总结:
光漂白和光损伤通常阻碍了单细胞或其他微米大小物体的高分辨率Z-Stack FLIM的记录。然而,对于较大的物体,对光稳定性的要求明显放宽。我们的研究结果表明,bh TCSPC FLIM系统能够记录x20显微镜镜头视场大小物体的高分辨率Z-Stack FLIM。利用Becker & Hickl DCS-120共聚焦FLIM系统的现有功能,我们记录了家蝇(Musca domestica) 289个Z轴切面,Z阶跃宽度为2.5µm, x和Y方向为1024 x 1024像素,1024时间通道。SPCM可以将所有平面或选定范围内的平面数据直接投影成单幅FLIM图像,并对结果进行SPCImage NG数据分析处理。通过SPCImage的批处理功能,可以对所有单个平面进行寿命分析。结果可以通过ImageJ / FIJI的Image Stacks功能进一步处理,提供样品时空特性的完整三维重建。
参考文献:
1. W. Becker, The bh TCSPC handbook. 10th edition (2023), available on www.becker-hickl.com
2. Becker & Hickl GmbH, DCS-120 Confocal and Multiphoton Scanning FLIM Systems, user handbook 9th ed. (2021). Available on www.becker-hickl.com
3. DCS-120 Confocal and Multiphoton Scanning FLIM Systems, Overview brochure, available on www.becker-hickl.com,
4. W. Becker, Bigger and Better Photons: The Road to Great FLIM Results. Education brochure, available on www.becker-hickl.com
5. Wolfgang Becker, Axel Bergmann, Markus Schubert, Stefan Smietana, Lifetime-intensity mode delivers better FLIM images. Application note, available on www.becker-hickl.com.
6. SPCImage NG data analysis software. In: W. Becker, The bh TCSPC handbook. 10th edition (2023)
7. J. Pawley (ed.), Handbook of biological confocal microscopy, 3rd edn., Springer (2006)
联系方式:
Wolfgang Becker
Becker & Hickl GmbH
Berlin, Germany
Nunsdorfer Ring 6-
Email: becker@becker-hickl.com
by admin
Share
by admin
Share
STAY IN THE LOOP