摘要
作者:Wolfgang Becker, Cornelia Junghans, Lukas Braun, Becker & Hickl GmbH
Alexander Jelzow, Toptica Photonics AG
我们用Toptica Photonics AG的femtofiber smart 780激光器结合Becker & Hickl DCS-120 MP TCSPC / FLIM系统演示了双光子FLIM。激光提供飞秒脉冲在783nm,80MHz重复频率,和125mW的平均功率。我们表明,激光功率在所有常见的FLIM应用足以获得高分辨率的图像。我们展示了该系统在组织的无标记(自体荧光)成像、细胞的无标记成像、生物材料中超快荧光衰减的FLIM以及荧光团标记的细胞和组织的FLIM方面的性能。
我们最近已经证明,典型生物样品的双光子FLIM可以使用190 mW, 40 MHz飞秒光纤激光器[6]。该系统为组织、细胞和小生物的无标记FLIM提供了极好的结果。我们还表明,即使激光波长不完全对应于荧光团吸收光谱的最大值,传统标记的样品也能提供出色的FLIM数据。因此,我们很想用新的783nm,125mW的Toptica femtofiber smart 780激光器进行同样的尝试。
在实验中,我们使用了现成的FemtoFibre Smart[5]与bh DCS120 MP FLIM系统[1]和尼康TE 2000倒置显微镜相结合。荧光光子被两个bh HPM-100-40或-06探测器[2,7]通过非扫描(NDD)光束路径[1,6]连接到显微镜上。一般光学系统配置请参见[6]。数据由两台bh SPC-180NX TCSPC / FLIM模块记录[2],并由bh SPCImage NG数据分析软件分析[3]。显微镜镜头为尼康x40 NA=1.3油浸物镜。
无标记成像
哺乳动物皮肤的NADH自体荧光图像如图1所示。样品平面上的激光功率约为5 mW,整个图像的平均计数率为3×106 每秒。
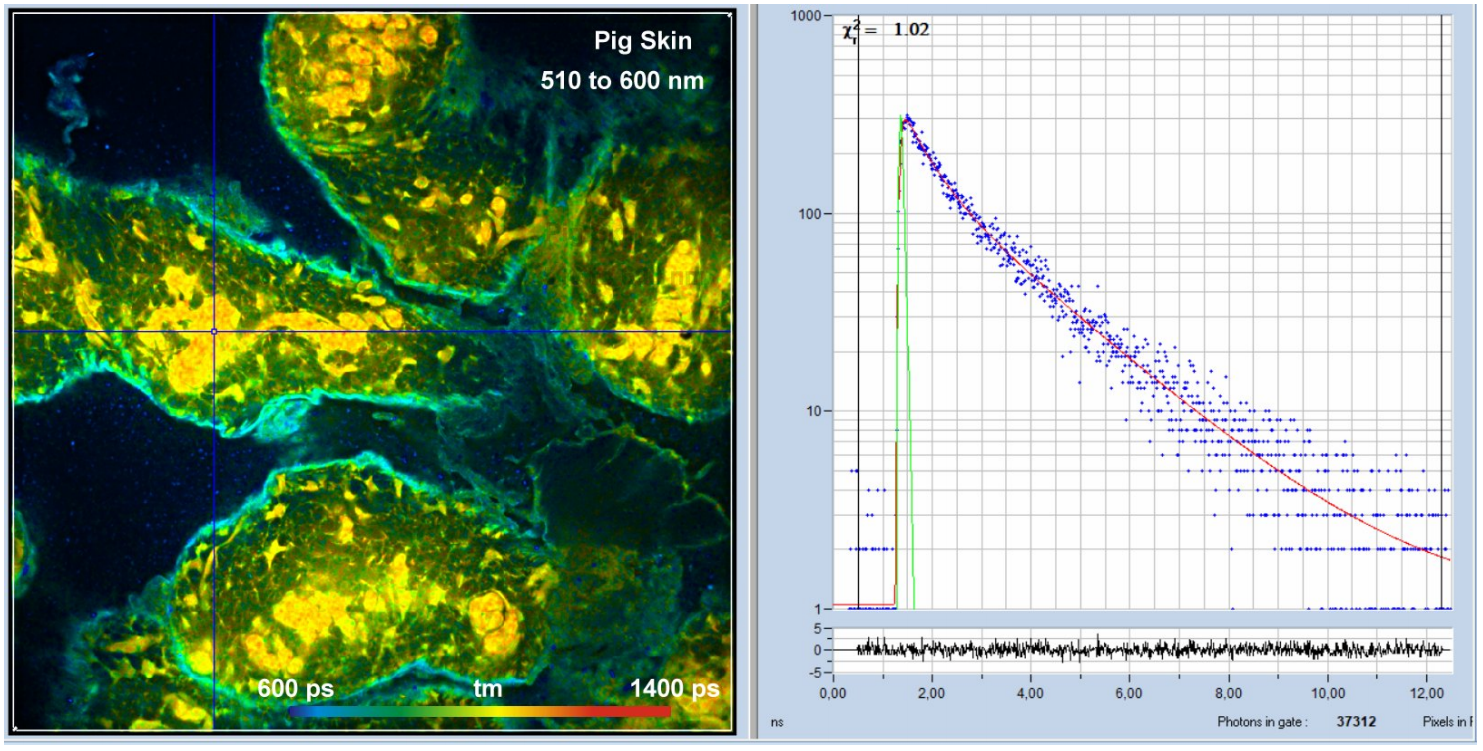
图1:猪皮肤,自体荧光,510 ~ 600 nm。1024 × 1024像素,1024个时间通道。检测范围从510 nm到600 nm,振幅加权寿命,tm。右边光标位置周围5×5像素区域的衰减曲线。
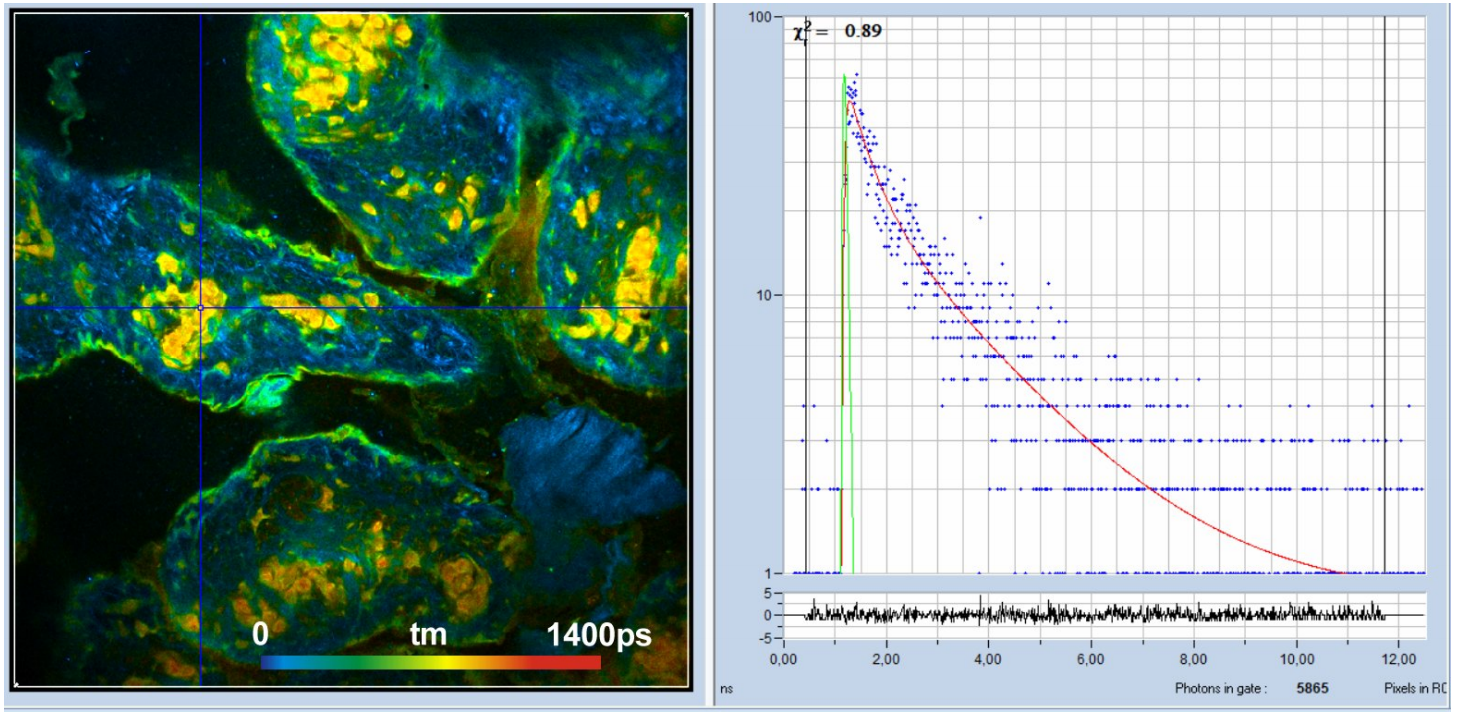
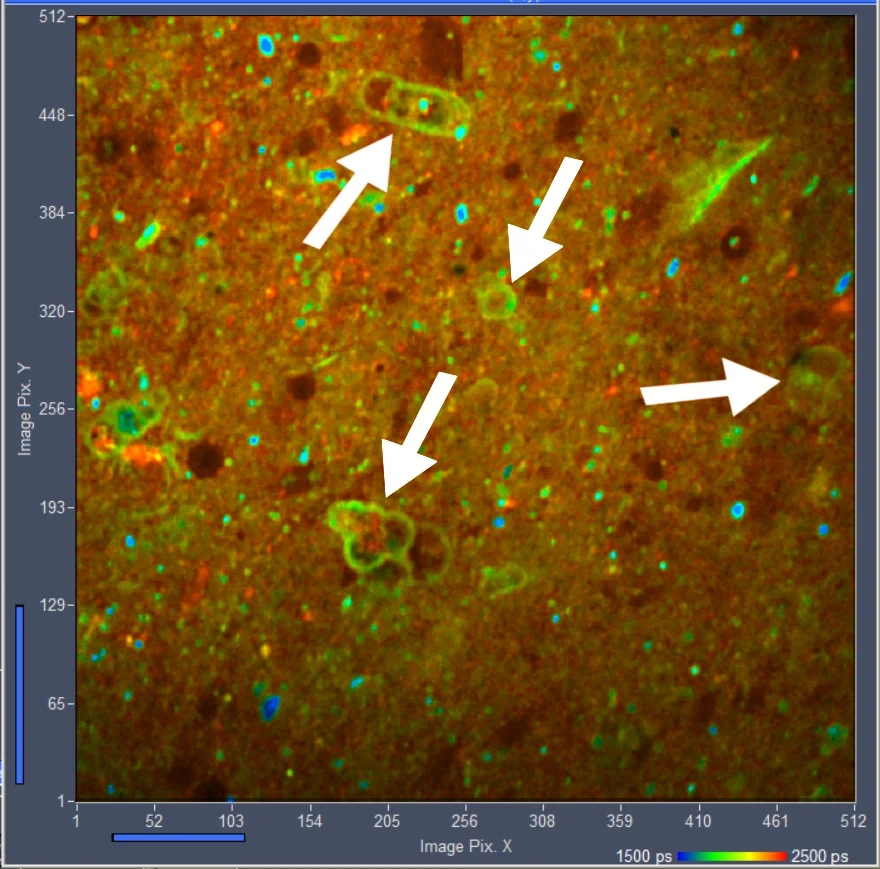
图2:猪皮肤,自体荧光,420 ~ 500 nm通道,1024 × 1024像素,1024时间通道。从520nm到600nm,双指数衰减的振幅加权寿命tm的检测。右边光标位置周围5×5像素区域的衰减曲线。
酵母细胞的FLIM图像如图3所示。在420 ~ 500 nm的检测通道中记录。样品平面内的激光功率约为5 mW。更高的功率对样品造成了直接的破坏。5mw时的计数率约为400,000 s-1。

图3:酵母细胞,420 ~ 500 nm, 1024 × 1024像素,1024时间通道。双指数衰减的振幅加权寿命tm。右边光标位置周围3×3像素区域内的衰减曲线。
超快衰减过程
图4为蘑菇孢子的FLIM图像,这是一个典型的荧光衰减极快的例子。为了更好地解决快速衰减问题,将时间通道的个数增加到4096个通道,记录时间间隔减小到2.5 ns。在这些条件下,每个时间通道的时间是600飞秒。IRF宽度约为18 ps fwhm,这是通过使用超高速HPM-100-06探测器实现的[2,7]。激光功率约为2 mW,计数率约为350,000s-1。在光标位置进行三指数衰减分析,平均寿命tm为33 ps,最快组件的寿命t1为9 ps。
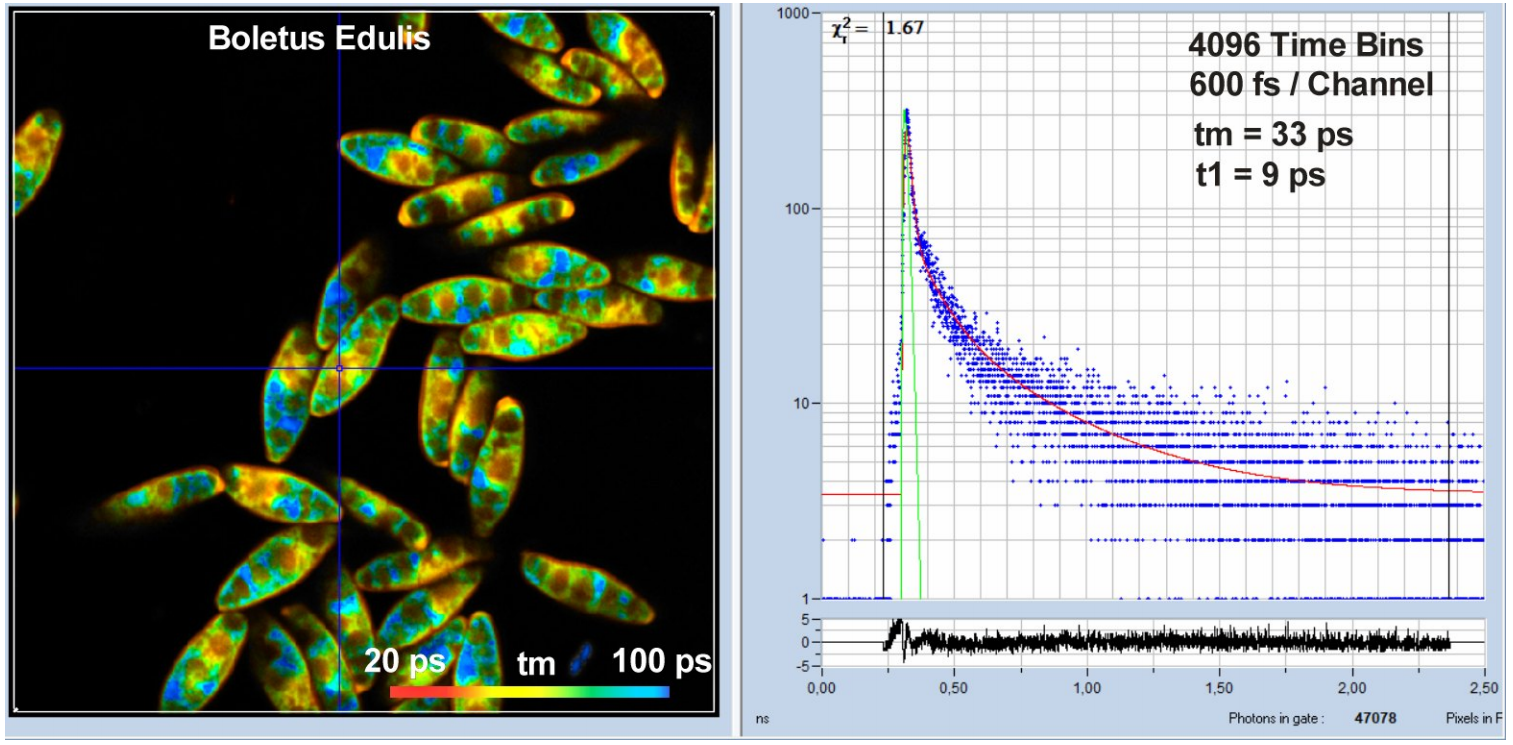
图4:肉芽孢杆菌孢子。512 × 512像素,4096时间通道,HPM-100-06探测器。时间通道宽度为600飞秒。IRF宽度为18 ps fwhm。衰减曲线如右图所示。
用标准荧光团标记的样品
图5显示了用Alexa 488、Mito Tracker Red和DAPI标记的BPEA细胞。在DCS-120 FLIM系统的两个光谱通道中同时记录图像。样品平面上的激光功率为3mw,三个荧光团都发出了明亮的荧光。每个通道的计数率在左图中约为2秒,在右图中约为4秒。原则上,通过增加激光功率可以获得更高的计数率。然而,这会导致可见的光漂白和平均荧光寿命的变化。
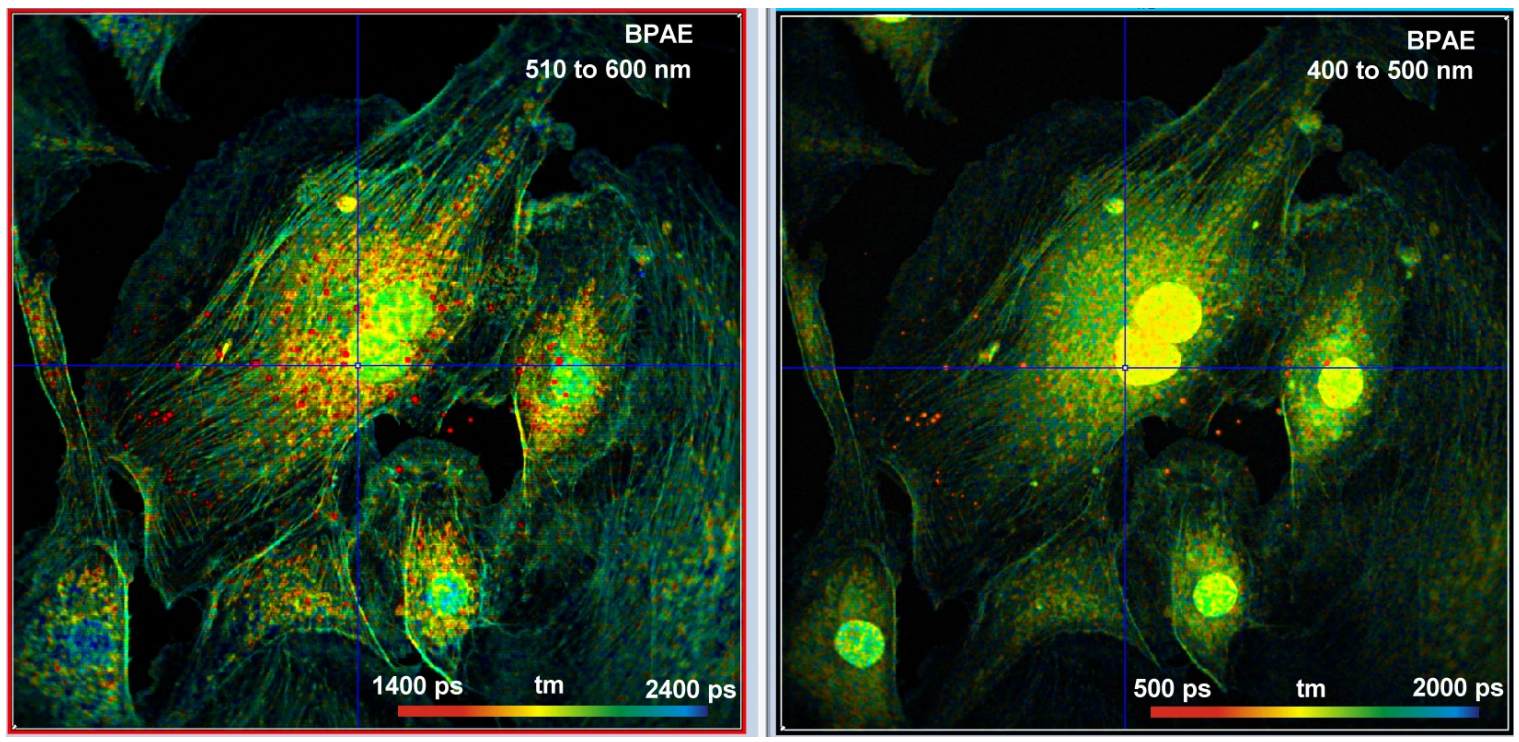
图5:用Alexa 488、Mito Tracker Red和DAPI标记的BPAE细胞。样品平面功率3mw。左:510 ~ 600 nm,计数率2×106 每秒。右:400 ~ 500 nm,计数率4×106每秒。
图6显示了用Alexa 488、Alexa 568和DAPI标记的小鼠肾脏切片。同样在这里,所有荧光团都获得了强烈的信号。当激光功率为3mw时,每个通道的计数率约为2x 106 s-1。
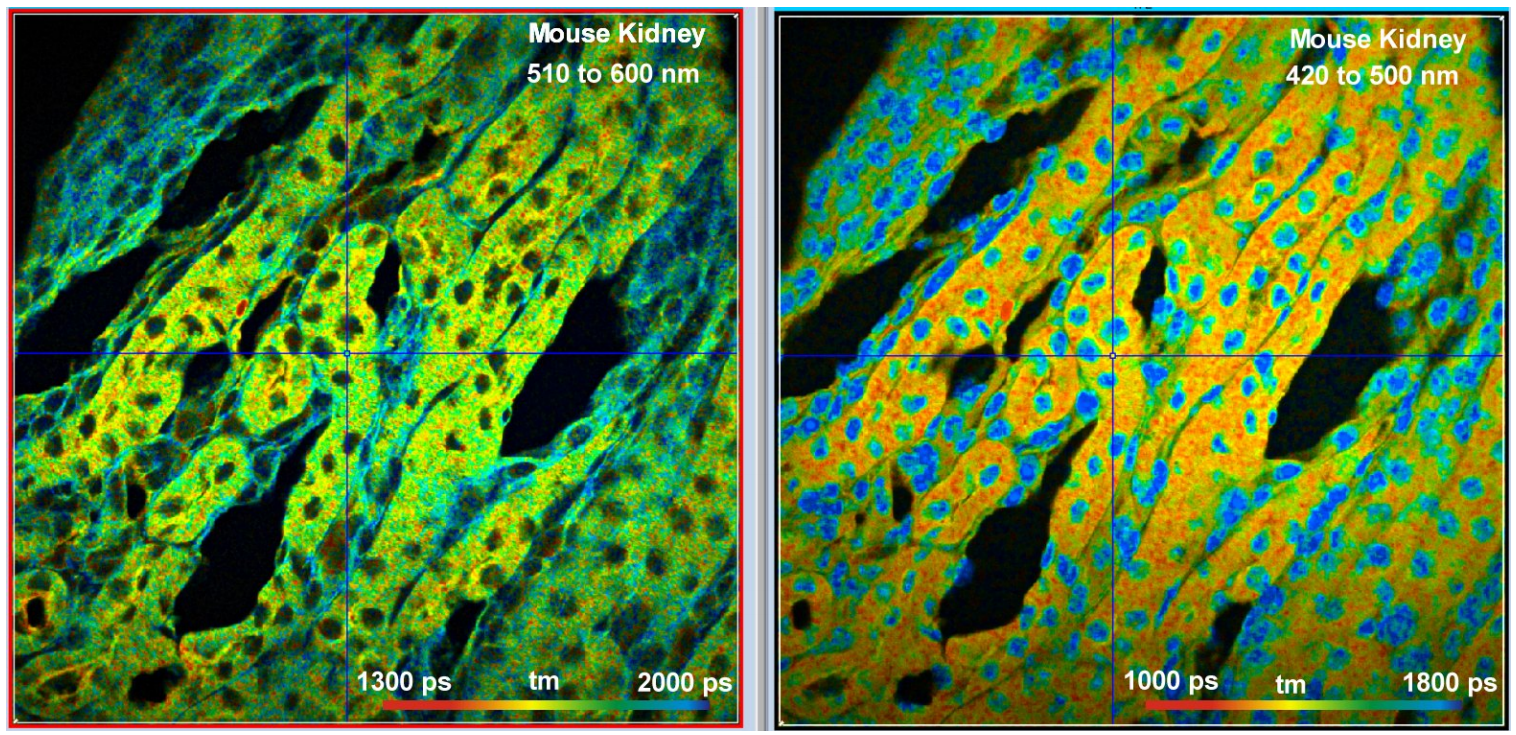
图6:用Alexa 488、Alexa 568和DAPI标记的小鼠肾脏样本。图像同时检测在两个光谱通道,1024 × 1024像素,1024时间通道。样品平面的激发功率为3mw,每通道的计数率约为2×106 s-1。
技术细节
显微镜物镜
激发效率和收集效率随显微镜物镜数值孔径的增大而增大。因此,建议使用尽可能大的NA的镜头。在FLIM应用中,对于大NA还有另一种说法:大于1的NA抵消了荧光衰减函数中的各向异性衰减分量[2]。因此,它避免了魔角偏振器的需要和相关的发射强度损失。在本文中,我们使用尼康x40 NA=1.3镜头进行测量。
激发光光束直径
显微镜物镜平面内的光束直径必须至少等于物镜背面孔径的大小。光束直径越小,空间分辨率越低,焦体积越大,激发效率越低。最好的分辨率不是像一般人认为的那样,用高斯光束填充透镜光圈,而是在整个直径上均匀地照射它。这只能通过过度照明来实现。过度照明还有一个优点,即扫描过程中的轻微移动不会导致光束离开光圈。这减少了经常遇到的强度向场的边缘下降。为了获得均匀的后孔径照明,激光束在DCS-120扫描头前扩展了两倍。尼康x40 NA=1.3镜头的后光圈被过度照明了两倍。由此产生的激发功率损失约为四倍。
激发功率
总结:
将bh DCS-120 MP FLIM系统与Toptica femtofiber smart激光器相结合,可以实现低成本、小尺寸的多光子FLIM系统。该系统能够在所有常用的FLIM应用中记录高质量的FLIM数据。由于其体积小且能够记录无标记(NADH)图像,它似乎特别适合于医院的代谢FLIM应用[2,8]。
参考文献:
1.Becker & Hickl GmbH, DCS-120 Confocal and Multiphoton Scanning FLIM Systems, user handbook 9th ed. (2021). Available on www.becker-hickl.com
2.W. Becker, The bh TCSPC handbook. 10th edition (2023), available on www.becker-hickl.com
3.SPCImage NG data analysis software. In: W. Becker, The bh TCSPC handbook. 10th edition (2023)
4. Overview brochure, available on www.becker-hickl.com
5.FemtoFiber smart compact and efficient fiber seed lasers. www.toptica.com/products/ps-fs-fiber-lasers/femtofiber-smart
6.W. Becker, C. Junghans, H. Netz, Two-Photon FLIM with a Femtosecond Fibre Laser. Application note, available on www.becker-hickl.com
7. Becker & Hickl GmbH, Sub-20ps IRF Width from Hybrid Detectors and MCP-PMTs. Application note, available on www.becker-hickl.com
8.W. Becker, R. Suarez-Ibarrola, A. Miernik, L. Braun, Metabolic Imaging by Simultaneous FLIM of NAD(P)H and FAD. Current Directions in Biomedical Engineering 5(1), 1-3 (2019)
9.W. Becker, Bigger and Better Photons: The Road to Great FLIM Results. Education brochure, available on www.becker-hickl.com
联系方式:
Wolfgang Becker
Becker & Hickl GmbH
Berlin, Germany
Nunsdorfer Ring 6-
Email: becker@becker-hickl.com
by admin
Share
by admin
Share
STAY IN THE LOOP