摘要
我们展示了使用电压敏感染料对细胞中的膜电位进行基于荧光寿命的成像。我们估计了膜电位的给定标准偏差所需的每个像素的光子数量,展示了提高精度的方法,并将预测与实际测量数据进行比较。在所描述的实验中,我们实现了几mV量级的膜电压标准偏差。
膜电位
细胞具有离子的浓度梯度穿过它们的膜。这些梯度在膜上产生电压 这是许多基本细胞过程的特征[1]。不幸精确测量膜电位的技术很少见。膜片钳 技术具有高度侵入性,不能提供空间分辨数据。 存在基于荧光强度的光学方法,但不是定量的。 比例强度成像尚未产生定量结果。一个有希望的解决方案是使用电压敏感染料的FLIM[10]。FLIM是 本质上是比率式的,因此能够提供定量结果[3,12]。 下图显示了加载了VoltageFluor VF2.1.Cl 的细胞的FLIM图像[10,11]。
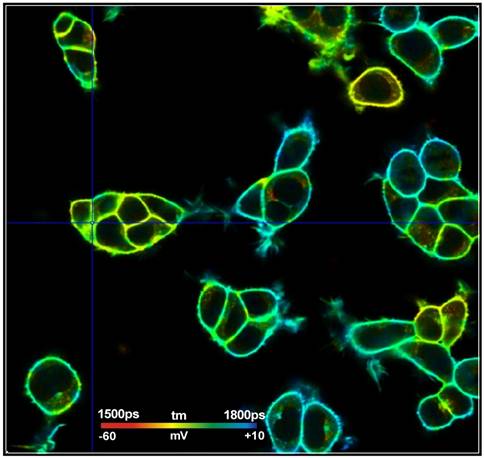
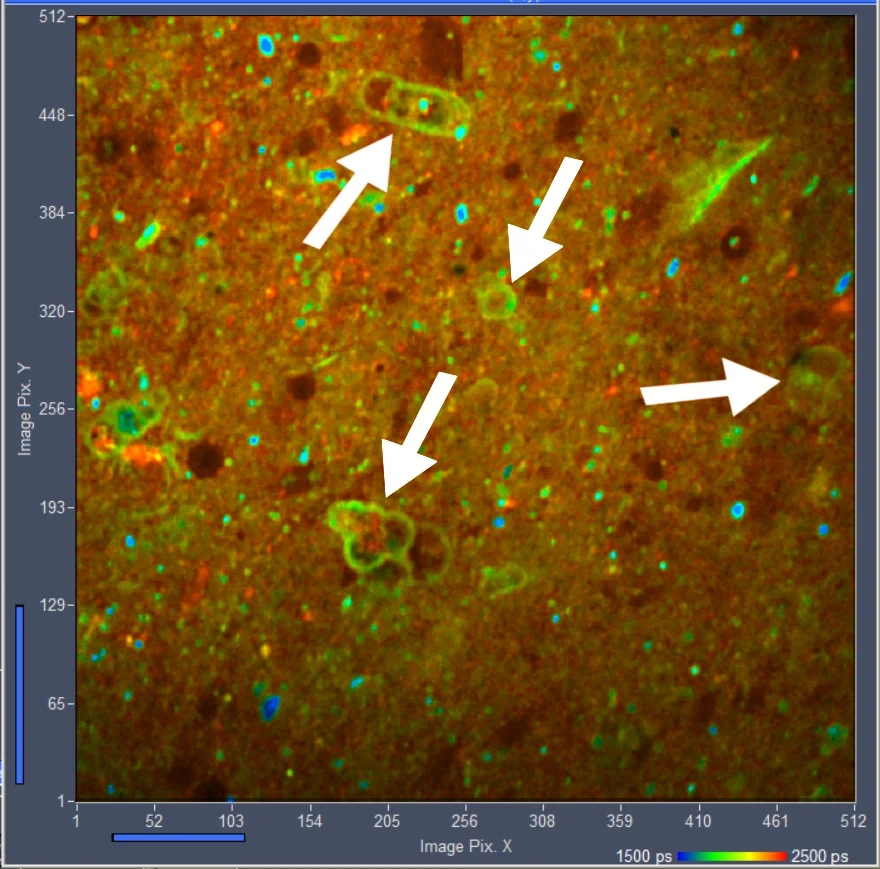
图 1: FLIM 加载有电压敏感染料的HEK细胞的图像。数据由苏珊娜提供 Yaeger-Weiss,伯克利大学
FLIM 格式为 512 x 512 像素,每像素 1024 个时间通道。数据由标准记录 Becker & Hickl (bh) 蔡司 LSM 980 激光器上的 TCSPC 系统 扫描显微镜。该系统包含两个并联的SPC-150NX TCSPC/FLIM 模块 [2, 7, 8] 与 HPM-100-40 混合探测器 [2]。对于激发,系统包含一个带有四个 皮秒二极管激光器的 bh “laser-hub” [9]。
用于测量的激发波长为445 nm,检测波长为525 nm至550 nm。 原始数据由bh SPCImage NG数据分析软件处理。 具有双指数不完全衰减的最大似然估计 (MLE) 模型用于拟合衰减数据。使用了SPCImage的合成IRF 对于反卷积,并使用双指数模型来拟合数据。这图像使用幅度加权寿命tm [4,5]进行颜色编码。一个 采用6的分档半径获得较高的信噪比tm, 请参阅“Binning”部分。
光标位置处的衰减曲线为 如图2所示。蓝点代表后续的时间通道的光子数,绿色曲线是IRF,红色曲线表示拟合双指数衰减模型。衰减参数显示在右上角。
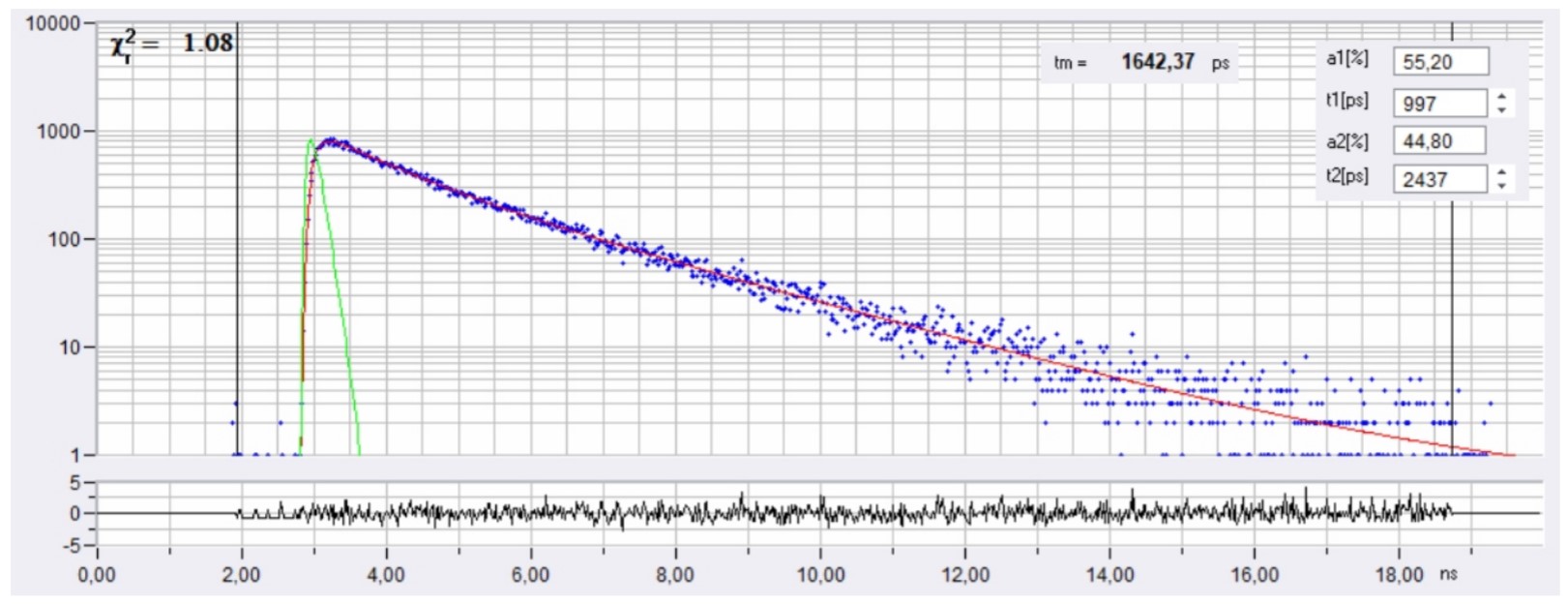
图2: 图1的光标位置处的衰减曲线。
FLIM图像和衰减曲线均为 数据高质量的证明。衰减数据的近乎完美的拟合可以得到。tm图像清楚地显示了寿命的异质性,这意味着不同的细胞具有不同的膜电位。
寿命电压校准
VF2.1.Cl 的校准数据在 [10]灵敏度s为3.5±0.08 ps/mV,零mV寿命为t0为 1.77±0.02 ns。在 -80 mV 至+80 mV的校准范围内, 寿命-电压关系为线性关系。校准曲线为 如图3所示.
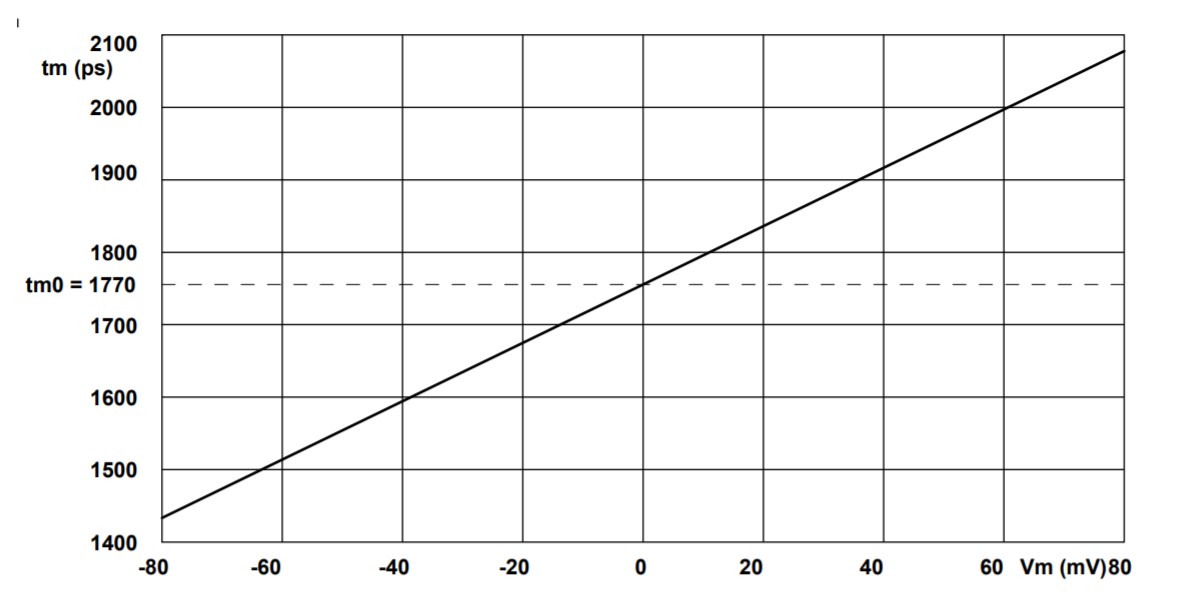
图 3:校准曲线,幅度加权寿命,tm与膜电位, Vm.从 [10] 重绘。
使用这些校准值,使用寿命 在图1上。分别转换为电压值,见Vm下的值 图像底部的颜色条。
Vm的标准偏差
使用上述校准值, Vm的标准偏差与每像素的光子数有关,或者, 相反,达到给定电压标准偏差所需的光子数量可以估计。
标准差,st,的荧光寿命 t,从具有多个光子 N 的衰减曲线获得,为

st 是 在理想条件下可以达到的精度。’在理想条件下记录“表示以远高于荧光寿命的时间分辨率记录衰减数据 ,没有明显的计数背景,并且整个衰减曲线位于观察时间间隔内。精心操作的TCSPC FLIM系统非常接近这些条件[2,3,6]。然而,要存衰减数据获得理想的St , FLIM数据分析必须以理想的效率进行。不幸的是,这并非完全可能。细胞中 VF2.1.Cl 的衰减曲线为双指数,[10] 中给出的校准值为幅度加权寿命,tm.振幅加权寿命可以 只能通过拟合过程获得,并且拟合程序不会提供 理想 St. 由此产生的精度损失由“光子效率Photon Efficiency”E描述 “,光子效率是 理想的记录和分析系统需要达到给定的精度光子数和真实系统需要的光子数的比值。 用真实系统获得的标准偏差,St real,为
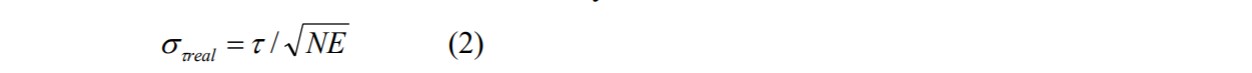
标准差,Sv,零电压点周围测得的膜电位,t0是

以及达到给定的 Sv所需的光子数量 是

对于SPCImage NG光子的MLE拟合 效率E约为0.7[6]。E=0.7时,光子数N与 所需标准偏差 SV,的 膜电压如图4所示
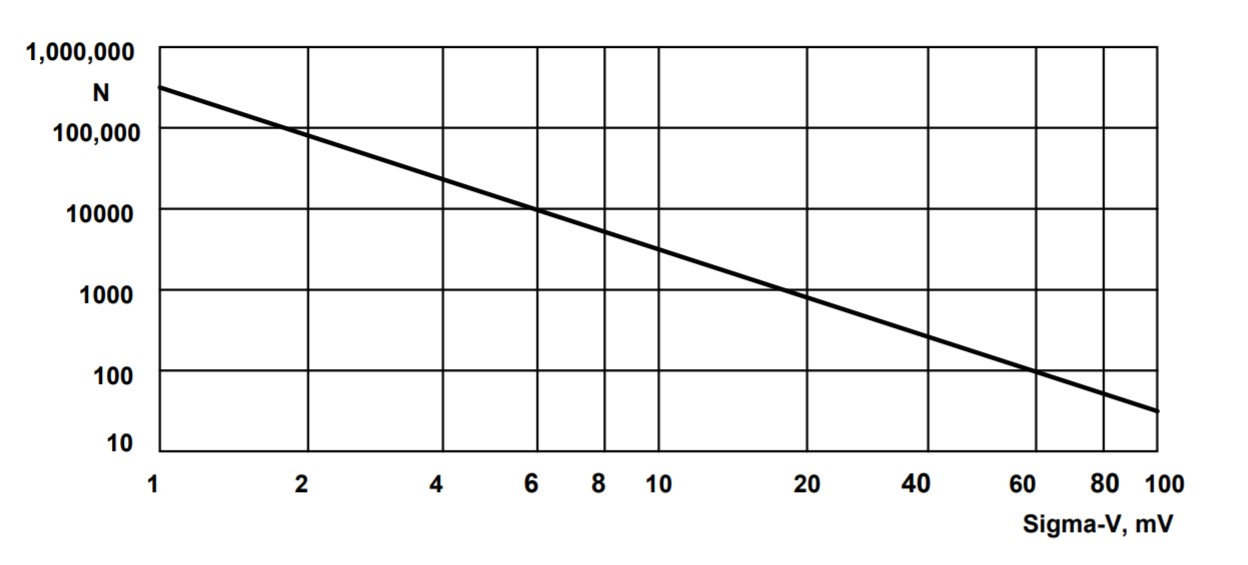
图 4: 所需标准偏差所需的每像素光子数 N,sV,膜电压,Vm
正如预期的那样,光子的数量 随电压的倒数标准差的平方而增加。对于10mV的标准偏差,需要 N=3400 个光子。这完全在 正常FLIM测量的范围。然而,低于该值,光子数变得不切实际地高。例如,对于2mV的标准偏差,每像素需要更多N=85000个光子。尽管如此,我们将展示如何在这个范围内实现光子数,从而实现优于10mV的Vm精度。
衰减数据的Binning
通过增加激发功率来增加光子数量的尝试通常会失败,因为成像过程不再是非侵入性的。相当一部分荧光团光漂白。光漂白产生自由基,自由基破坏细胞或至少损害细胞的代谢功能。原则上,延长获取时间以获取更多光子是可能的。bh FLIM系统非常稳定,可以在数小时内进行采集[2]。然而,在这里,光反应也设置了采集时间的限制。此外,样本中的运动会导致图像在较长时间内模糊。
SPCImage NG的重叠Binning函数可以大幅增加光子数。该函数保持图像的像素数不变,但对于每个像素,将其周围几个像素的衰减数据合并到衰减分析中。为了获得最佳的空间分辨率,对显微镜图像进行过采样,这一过程是合理的。这意味着点扩散函数被采样(通常)5×5像素或更多。这些像素内的衰减信息是高度相关的。因此,重叠binning不会损害寿命数据的空间分辨率。有关详细信息,请参见[4,5,6]。在使用VF2.1.Cl进行膜电位成像的情况下,Binning功能特别有效。荧光团严格粘附在细胞膜上。膜外几乎没有荧光。
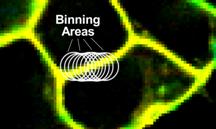
图5:SPCImage中衰减数据的二进制化。每个像素的衰减数据与周围较大区域的数据相结合。用于图像中指示的相邻像素的Binning区域(Bing半径bin=6)。
实验结果
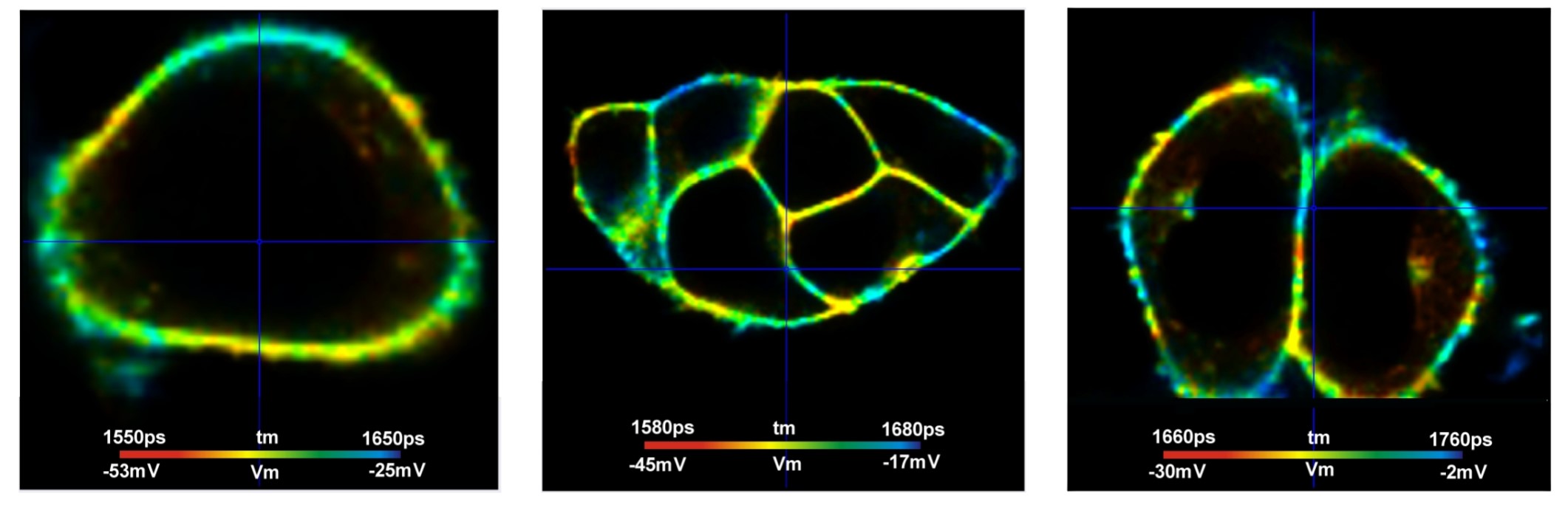
细胞膜上任意选择的像素的衰减曲线如图6所示。。从左到右,Bing半径分别为1、6和10。可以看出有效光子数是如何随着Binning半径而增加的。图7显示了Binning半径1(顶部)和Binning半径6(底部)的寿命/Vm图像。右侧显示了三个不同感兴趣区域(ROI)的寿命tm直方图。对于bin=1,直方图是宽的并且重叠的。对于bin=6,直方图变得明显分离,揭示了不同细胞之间的真实Vm异质性。
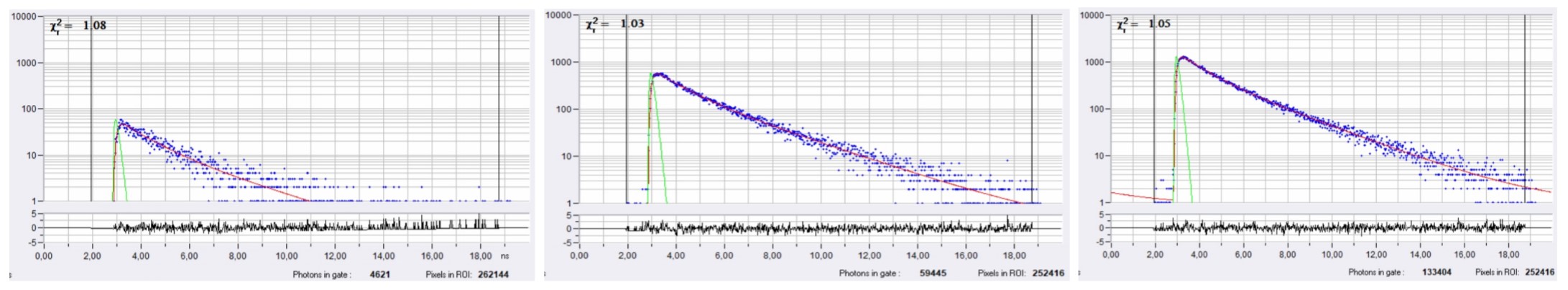
图6:SPCImage中不同Binning半径下细胞膜上任意选择像素的衰减曲线。左:Bin=1,N=4621,中:Bin=6,N=59445,右:Bin=10,N=133404。注意对数刻度。Vm的预期标准偏差分别为8.5 mV、2.3 mV和1.6 mV。
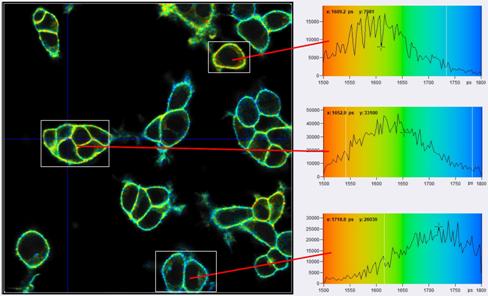
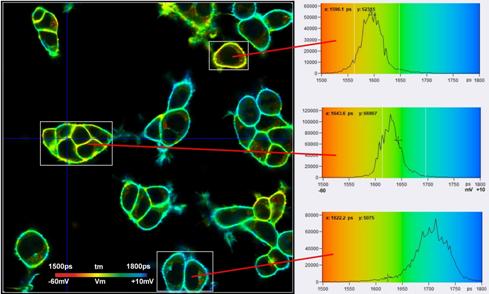
图7:FLIM图像和三个不同感兴趣区域的tm直方图。上图:Binning radius bin=1。直方图很宽而且重叠。下图:Binning radius bin=6。直方图被清楚地分离,表明样品中的真实Vm异质性。数据与图1相同,使用SPCImage NG进行分析,MLE拟合。tm范围为1500 ps至1800 ps,Vm范围为-65 mV至+10 mV。
图7显示TCSPC FLIM以前所未有的分辨率提供膜电位。然而,感兴趣区域中的直方图比方程2和3预测的要宽。在Binning区域中光子数N约为60000的情况下,E=0.7,以及
tm >> 1.7ns,St 应该是大约8.3ps,并且 Sv约2.3 mV。然而ROI中的tm直方图具有大约40ps、45ps和70ps的宽度(最大值为一半时的全宽度)。这转化为St 约17ps、19ps和30ps,以及Sv约为4.8 mV、5 mV和8.5 mV。这意味着标准偏差约为预期的两倍大。基于无数其他FLIM数据的分析结果[6],我们可以排除方程(2)和(3)是错误的,或者E显著低于0.7。剩下的唯一解释是,在单个ROI内仍然存在Vm异质性。事实似乎确实如此。
图8显示了单独调整的选定ROI中的单元格tm和Vm标度。在这个尺度上,寿命和膜电压出现了非随机变化,这在图7中并不明显,底部。因此,我们认为Vm分辨率高于tm直方图的宽度,并且确实接近预期值Sv=2.3 mV。

图8:图7中标记的感兴趣区域中的细胞。单独调整的寿命/电压范围。
总结
基于FLIM的膜电位测量以几mV的标准偏差在膜上提供电压。如方程(3)所示,精度随着每个像素的有效光子数以及记录技术和衰减分析的光子效率E的增加而增加。TCSPC FLIM与MLE分析相结合可提供最大N和接近理想E。因此,它是膜电位测量的首选方法。方程(3)进一步表明,精度随着寿命的比率而增加,t0和荧光团的电压灵敏度s。因此,电压敏感探针的候选者不仅应选择用于高s,而且应选择用于短寿命。
在影响电压分辨率的所有参数中,每个像素的有效光子数N具有最大的影响。通过更高的激发功率或更高的荧光团浓度来增加N的尝试通常失败。过高的激发功率会导致光漂白、自由基的产生、细胞代谢的变化,最终导致细胞损伤。增加细胞膜中的荧光团浓度,如果本身对细胞没有毒性,很可能会导致不同分子的激发态耦合,并导致不可预测的寿命变化。
SPCImage NG的Binning函数大大增加了有效N。该函数利用了显微镜图像过采样的事实,因此重叠Binning对寿命分析的空间分辨率几乎没有影响。
对于VF2.1.Cl,探针Binning得到了进一步的支持,因为它几乎定量地结合到膜上。因此,膜处的衰减函数不受膜外荧光的污染,因此可以使用大的Binning半径。通过重叠装仓实际实现的光子数和电压精度分别为16个和4个量级的改进。
当然,每个像素的光子数N也可以通过减少原始数据中的像素数来增加。然而,减少像素数量会降低空间分辨率,因此不如SPCImage中的重叠Binning。原始数据应始终记录一个像素数,该像素数能够充分解析样本的空间结构。
提高精度的另一个有用选项是增加采集时间。本文件中显示的数据是在147秒或约2.5分钟的采集时间内记录的。与其他FLIM应用程序相比,这听起来可能很多。然而,增加到5分钟甚至10分钟似乎是可行的。Vm的标准偏差将分别提高1.4和2倍。bh TCPSPC系统足够稳定,可以运行采集10分钟或更长时间。细胞是否在这样一段时间内保持其空间位置和代谢状态,必须通过未来的实验来证明。
试图提高数据分析的光子效率E是没有希望的。原则上,通过使用一阶矩分析,E可以增加到1[5,6]。然而,一阶矩分析仅提供荧光衰减的单指数近似的寿命。这可能会导致多指数衰减函数的问题,并意味着必须创建新的校准数据。此外,E已经是0.7。将其增加到1只会在准确性上产生微小的提高。
最后,应该提到的是,不利的记录条件可能会导致记录光子数量和光子效率的巨大变化。正确的聚焦、共焦系统中正确的针孔对准、显微镜透镜的高数值孔径以及抑制室内光泄漏到检测光路中都是强制性的。有关详细信息,请参见[6]。
需要注意的是,本文中的考虑仅适用于光子统计引起的误差。它们不包括系统效应,例如TCSPC电子器件的时序稳定性或激光器的时序稳定性。bh-TCPC/FLIM模块的时序稳定性优于一ps(标准偏差)[2]。包括bh-ps二极管激光器在内的整个FLIM系统的时序稳定性优于5ps。数据分析补偿了部分偏移。因此可以得出结论,系统误差不大于几个ps,或者膜电位约为1mV。
另一个潜在的误差是校准曲线在不同分子环境下的不确定性。发现不同HEK293T细胞的寿命差异高达70 ps,膜电位差异高达20 mV[10]。这是统计误差的10倍。有趣的是,校准曲线中的差异与图7中单个细胞之间的差异在相同的顺序上。这些细胞具有完全相似的类型,在相同的培养基中生长,并且含有相当浓度的VF2.1.Cl。很难相信VF2.1.Cl在这些细胞中表现不同。不同Vm的原因很可能并非不同tm特性,但细胞的代谢状态不同。如果这是正确的,不同的代谢状态也可以解释校准曲线中的差异。通过NAD(P)H[2]衰变成分的振幅测量代谢状态可能有助于回答这个问题。
鸣谢
我们感谢伯克利大学的Julia R.Lazzari Dean、Anneliese M.M.Gest、Evan W.Miller和Susanna Yaeger Weiss的工作,他们开发了使用电压敏感染料对膜电位进行基于FLIM成像的技术。特别感谢Susanna Yaeger-Weiss记录了VF2.1.Cl培养的HEK细胞的高质量FLIM数据。
参考文献
1. L. Abdul Kadir, M. Stacey, R. Barrett-Jolley, Emerging roles of the membrane potential: Action beyond the action potential. Frontiers in Physiology 9:1661 (2018)
2. W. Becker, The bh TCSPC handbook. 9th edition (2021), available on www.becker-hickl.com
3. W. Becker, Advanced time-correlated single-photon counting techniques. Springer, Berlin, Heidelberg, New York, 2005
4. Becker & Hickl GmbH, SPCImage Next Generation FLIM data analysis software. Overview brochure, available on www.becker-hickl.com
5. SPCImage Data Analysis, in W. Becker, The bh TCSPC Handbook. 9th ed. Becker & Hickl GmbH (2021)
6. W. Becker, Bigger and Better Photons: The Road to Great FLIM Results. Education brochure, available on www.becker-hickl.com.
7. Becker & Hickl GmbH, Modular FLIM systems for Zeiss LSM 710 / 780 / 880 family laser scanning microscopes. User handbook, 7th ed. (2017). Available on www.becker-hickl.com
8. Becker & Hickl GmbH, FLIM systems for Zeiss LSM 980. Addendum to handbook for modular FLIM systems for Zeiss LSM 710/780/880 family laser scanning microscopes 7th ed., available on www.becker-hickl.com, please contact bh for printed copies
9. Becker & Hickl GmbH, LHB-104 Laser Hub. User Manual. Available on www.becker-hickl.com.
10. J.R. Lazzari-Dean, A.M.M Gest, E.W. Miller, Optical estimation of absolute membrane potential using fluorescence lifetime imaging
11. E.W. Miller, J.Y. Lin, E.P. Frady, P.A. Steinbach, W.B. Kristan, R. Y. Tsien, Optically monitoring voltage in neurons by photo-induced electron transfer through molecular wires. PNAS 109 (6), 2114-2119 (2012)
12. K. Suhling, L. M. Hirvonen, J. A. Levitt, P.-H. Chung, C. Tregido, A. le Marois, D. Rusakov, K. Zheng, Fluorescence Lifetime Imaging (FLIM): Basic Concepts and Recent Applications. In: W. Becker (ed.) Advanced time-correlated single photon counting applications. Springer, Berlin, Heidelberg, New York (2015)
Contact:
Wolfgang Becker
Becker & Hickl GmbH
Berlin, Germany
Email: becker@becker-hickl.com
by admin
Share
by admin
Share
STAY IN THE LOOP