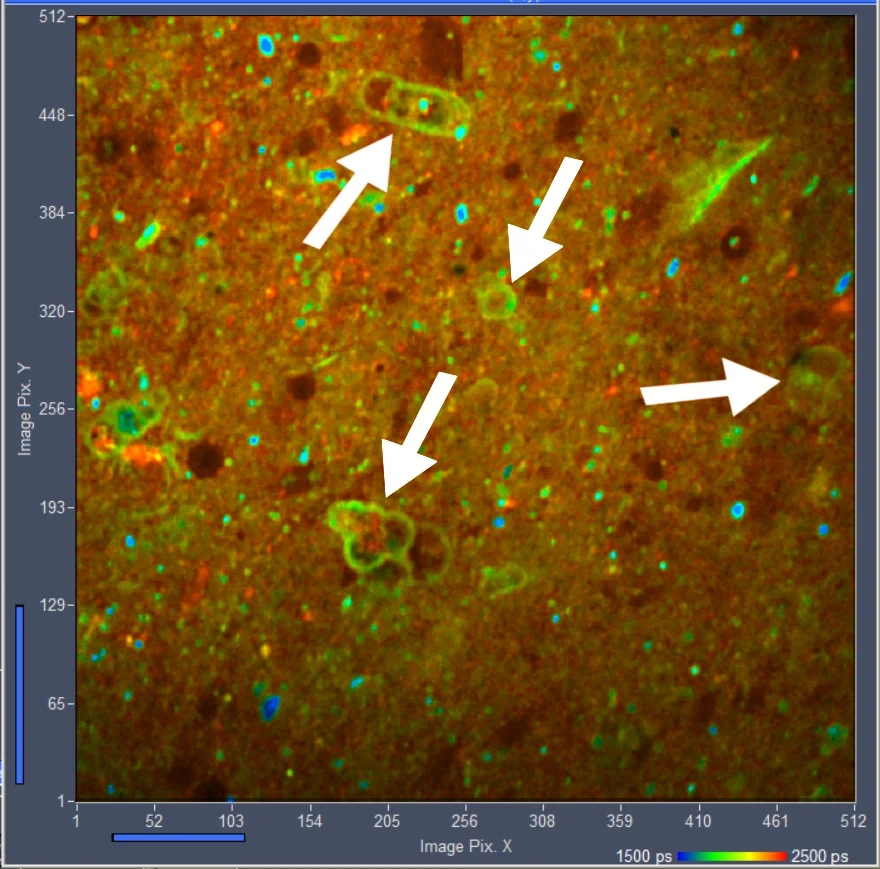
图1:酵母细胞的FLIM图像,显示色氨酸荧光。双光子激发波长为540 nm,检测波长范围为320至380 nm。
色氨酸荧光
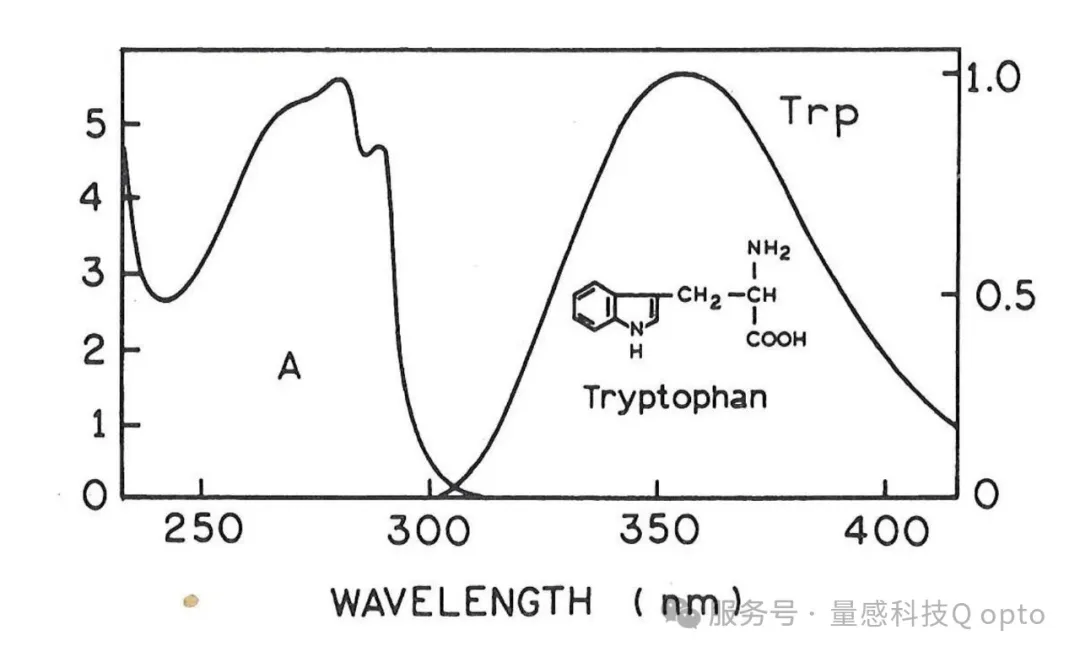
色氨酸 (TRP) 荧光寿命成像的问题在于激发和发射波长均在紫外区。激发波长最大值约为 280 nm,发射波长范围从约 300 nm 延伸至 400 nm [9]。色氨酸的吸收和发射光谱如图 2 所示。
图 2:色氨酸的吸收光谱(左)和发射光谱(右)(源自[9])
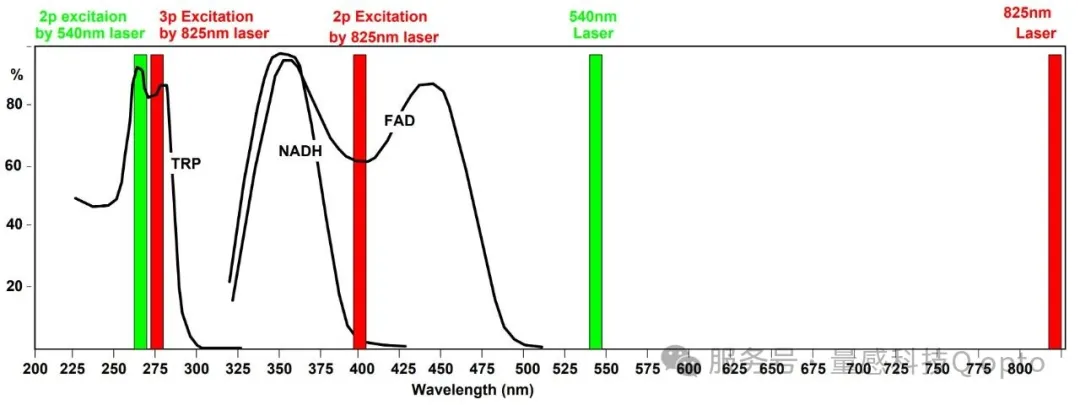
另一种可能性是通过双光子(2p)激发色氨酸。色氨酸的最佳激发波长范围为530至560 nm。NADH或FAD在此波长下没有明显的吸收,见图3。因此,可以预期光损伤将保持在可接受的水平。直到最近,问题在于还没有合适的、具有所需波长的飞秒激光器。现在,波长为540 nm的飞秒激光器已经问世[11]。这促使我们尝试利用2p激发对色氨酸进行双光子荧光显微成像(FLIM)。
图3:多光子激发TRP。红色:825 nm激光。绿色:825 nm激光。可以看出,825 nm的3p激发也能激发FAD。540 nm的双光子激发不存在此问题。
双光子色氨酸荧光免疫荧光系统
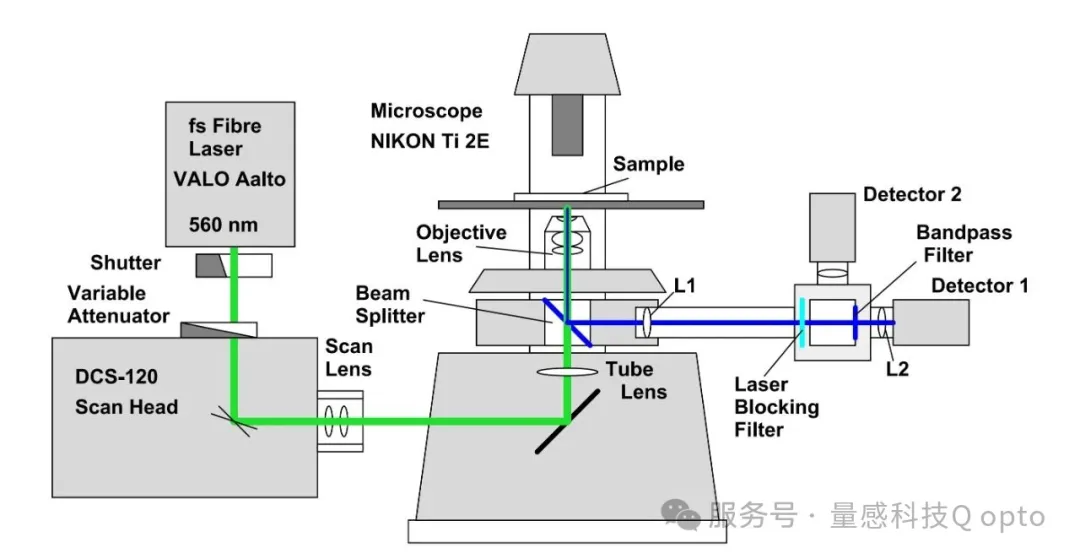
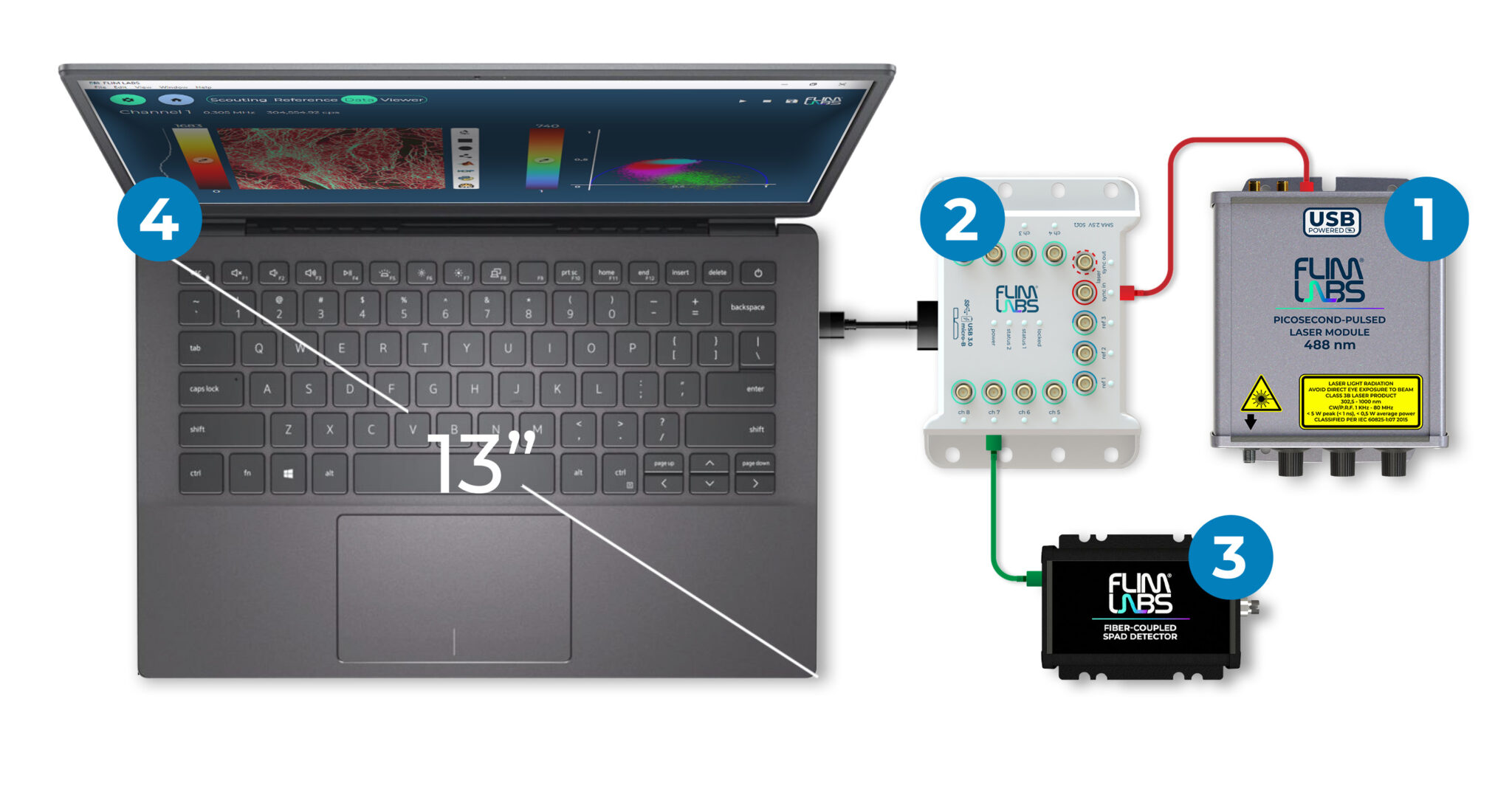
我们的色氨酸系统基于Becker & Hickl 标准的DCS-120 MP多光子荧光显微成像系统。其原理如图4所示。
图4:双光子色氨酸FLIM系统的光学原理
光学部分由 bh公司 DCS-120 共聚焦扫描头 [ 4 ]、尼康 Ti-2E 显微镜、带 SHG 选项的 560 nm VALO Aalto 飞秒激光器(德国HÜBNER Photonics公司) [11] 和两个 HPM-100 混合型单光子探测器 [3] 组成。其原理如图 4 所示。激光器在 540 nm 的波长下输出 50 mW 的光功率。激光束经过一个快门和一个可变衰减器。扫描由 DCS-120 MP 共聚焦扫描头进行。扫描头的扫描透镜将激光束沿着显微镜光束路径投射到显微镜镜头。[3, 4]。为了获得高激发和检测效率,我们使用了 40X NA=1.3 油浸物镜。荧光通过显微镜镜头收集回来,通过显微镜滤光片转盘中的 520 nm 二向色分束器与激发光分离,并通过显微镜后端口发出。光线通过常规 NDD(非扫描检测)光束路径 [3] 传输到单光子探测器。散射激光由 500 nm 短波通滤光片滤除。DCS-120 系统有两个单光子探测器。为了记录色氨酸,我们只使用了其中一个。检测到的信号进一步通过 360/40 带通滤光片净化。信号由 bh 的多维 TCSPC FLIM 工艺 [2, 3, 5] 通过 DCS-120 系统的两个 SPC-180NX FLIM 模块 [3] 之一记录。更多详情,请参阅 [ 3,4 ]。
结 果
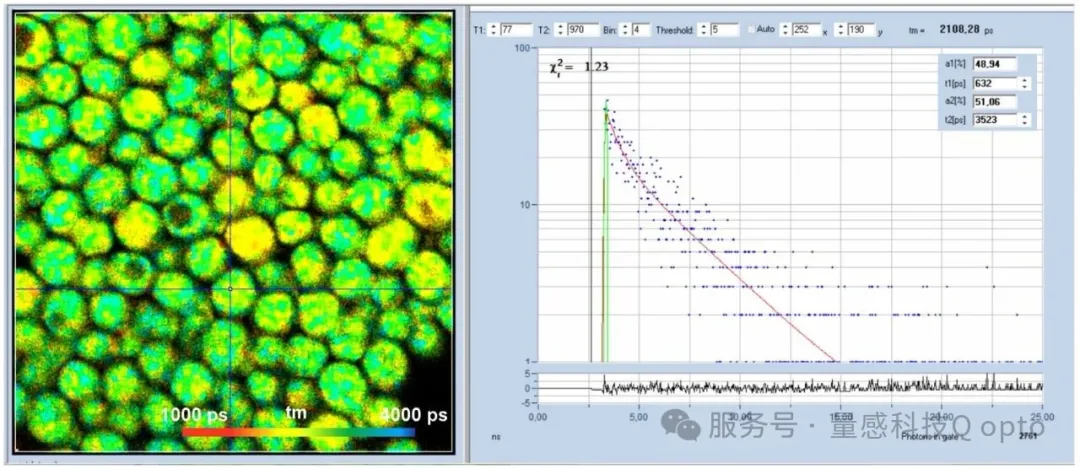
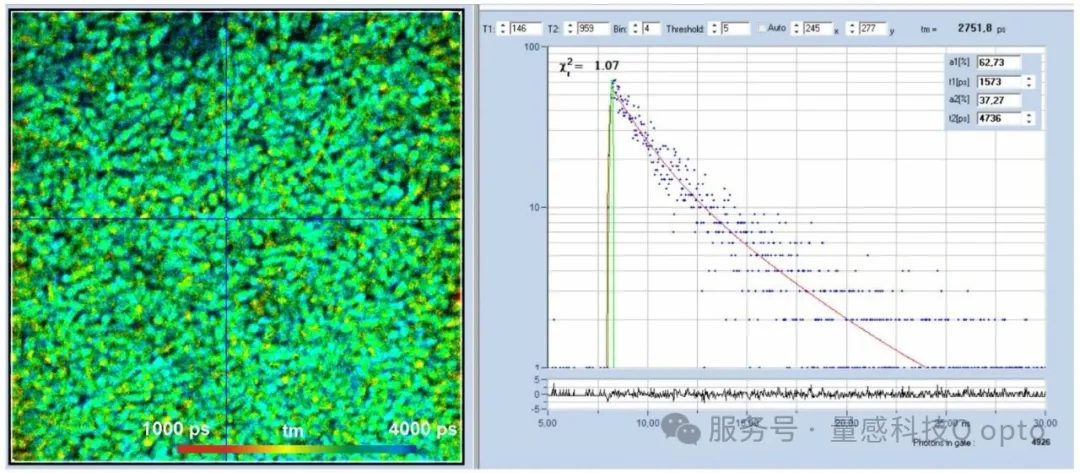
图5为活酵母细胞色氨酸荧光寿命图像。样品平面激发功率为2 mW,采集时间为60秒。计数率为9 × 104 个光子/秒,在此时间内采集了5.5×106个光子。该光子数量足以进行双指数衰减分析。光标位置处的衰减组分分别为632 ps快寿命组分(占比49%)和3525 ps慢寿命组分(占比51%),振幅加权寿命为2108 ps。
图5:酵母细胞色氨酸荧光寿命成像。左图:寿命图像。双指数衰减的振幅加权寿命。右图:光标位置的衰减函数。图像格式:512 x 512像素,1024个时间通道,540 nm双光子激发,寿命范围:1000 ps至4000 ps。使用bh SPCImage NG 9.0软件进行分析[6]。
图6展示了活体大肠杆菌(E. coli)的色氨酸荧光寿命图像。大肠杆菌并非易事,它们体型较小,移动速度很快。该图像的采集时间为90秒。整幅图像包含约1000万个光子。采用双指数衰减模型对图像进行分析。光标位置处的衰减组分分别为1573 ps快寿命组分(占比62.7%)和4740 ps慢寿命组分(占比37.3%)。振幅加权寿命为2762 ps。
图6:大肠杆菌中色氨酸的荧光寿命成像(FLIM)。左图:寿命图像。双指数衰减的振幅加权寿命。右图:光标位置的衰减函数。512 x 512像素,1024个时间通道,540 nm双光子激发,寿命范围为1000 ps至4000 ps。使用bh SPCImage NG 9.0软件进行分析[6]。
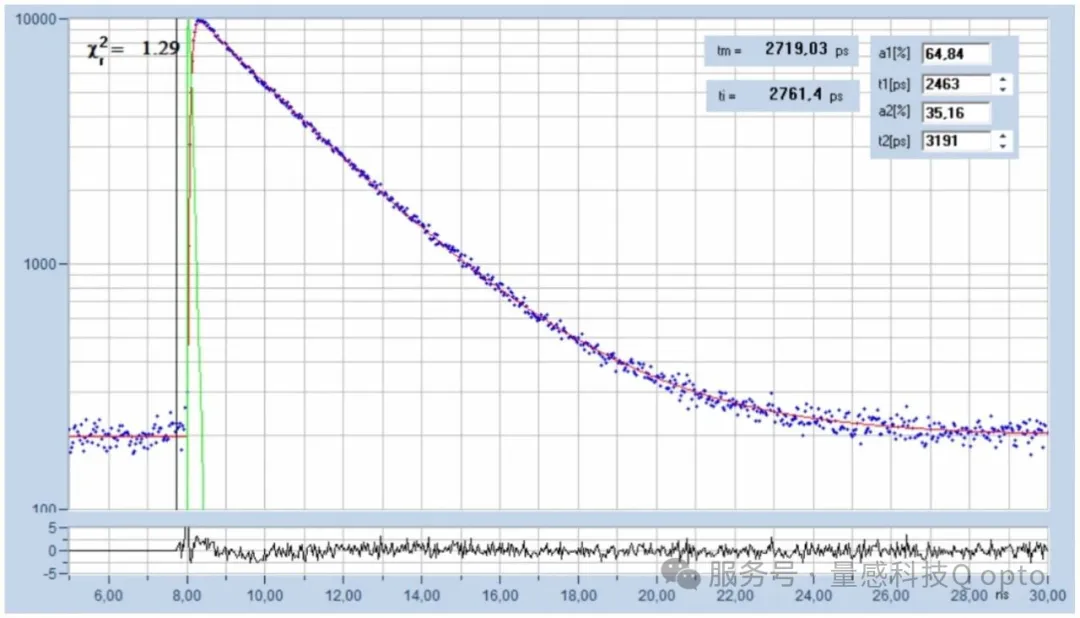
为了进行比较,图7显示了色氨酸在水溶液中的衰减曲线。该数据采用与上述FLIM数据相同的系统采集,该曲线是通过将单条衰减曲线中所有像素的数据合并而创建的[6]。
图7:色氨酸在水中的衰减曲线。采用与FLIM图像相同的系统记录。采集时间为160秒,使用bh SPCImage NG 9.0软件进行分析。
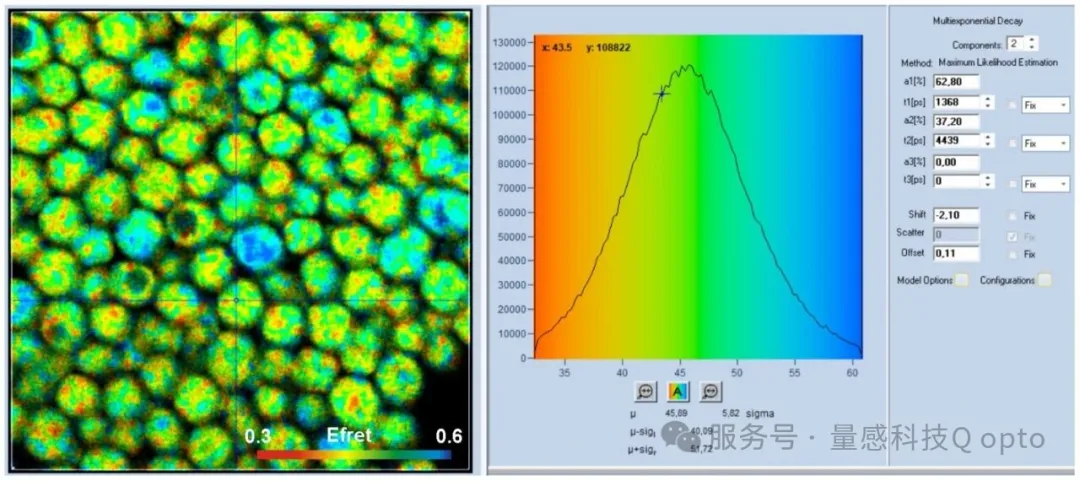
2463 ps 的组分占比为 64.8%,3192 ps 的组分占比为 35.2%,衰减接近单指数。振幅加权寿命为 2719 ps。这些值与从酵母细胞和大肠杆菌细胞中获得的寿命相符。这有力地表明,细胞中的发射实际上来自色氨酸。细胞中的衰减函数更接近双指数(a 1 高于溶液中,t 1低于溶液中),这可以通过 TRP 环境的异质性以及可能通过从 TRP 到 NADH 的 FRET 来解释。FRET 已在 PCa 细胞中发现 [1],并且似乎也发生在酵母和大肠杆菌细胞中。尝试计算酵母细胞中假设的FRET效率,得到了如图8所示的FRET图像。左侧是经典FRET效率[7]的彩色编码图像,右侧显示了光标位置处的FRET效率分布和衰减参数。最常见的FRET效率为0.46,这对于TRP-NADH FRET来说是一个合理的值。
图 8:假设的 TRP-NADH 能量转移的 FRET 图像。左图:图像显示颜色编码的(经典)FRET 效率。右图:FRET 效率在像素上的分布以及光标位置处的衰减参数。使用 bh SPCImage NG 9.0 软件进行分析。
总 结
我们介绍了一种可记录活细胞中色氨酸 (TRP) 荧光寿命图像的荧光寿命成像 (FLIM) 系统。该系统基于标准 bh DCS-120 MP 多光子荧光寿命成像 (FLIM) 系统 [4]。与已知的三光子方法不同,该系统采用新型 540 nm飞秒激光器(德国HÜBNER Photonics公司)进行双光子激发 [11]。这样可以避免 NADH 和 FAD 的不必要激发造成的光损伤。我们通过记录大肠杆菌细胞和酵母细胞的 TRP 图像演示了该系统的使用。样品平面的激发功率约为 3 mW,TRP 发射带的计数率约为每秒 90,000 至 100,000 个光子。衰减函数呈双指数函数,酵母细胞的寿命组分为 632 ps 和 3525 ps,大肠杆菌细胞的寿命组分为 1573 ps 和 4740 ps。 TRP在溶液中的寿命组分分别为2463ps和3192ps。
参考文献
- S. R. Alam, H. Wallrabe, Z. Svindrych, A. K. Chaudhary, K. G. Christopher, D. Chandra, A. Periasamy, Investigation of Mitochondrial Metabolic Response to Doxorubicin in Prostate Cancer Cells: An NADH, FAD and Tryptophan FLIM Assay. Scientific Reports 7 (2017)
- W. Becker, Advanced time-correlated single-photon counting techniques. Springer, Berlin, Heidelberg, New York, 2005
- W. Becker, The bh TCSPC handbook. 10th edition. Becker & Hickl GmbH (2023), www.becker-hickl.com, printed copies available from bh
- Becker & Hickl GmbH, DCS-120 Confocal and Multiphoton FLIM Systems, user handbook, 9th ed. (2021). Available on www.becker-hickl.com
- Becker & Hickl GmbH, The bh TCSPC Technique. Principles and Applications. Available onwww.becker-hickl.com.
- W. Becker, A. Bergmann, SPCIMage NG FLIM data Analysis. In: W. Becker, The bh TCSPC handbook. 10th edition (2023), available on www.becker-hickl.com
- W. Becker, Axel Bergmann, Double-exponential FLIM-FRET is free of calibration. Application note,www.becker-hickl.com(2023)
- V. Jyontikumar, Y. Sun, A. Periasamy, Investigation of tryptophan-NADH interactions in live human cells using three-photon fluorescence lifetime imaging and Förster resonance energy transfer. J. Biomed. Opt. 2013, 060501-1 to 060501-3 (2013)
- J.R. Lakowicz, Principles of Fluorescence Spectroscopy, 3rd edn., Springer (2006)
- Q. Li, S. Seeger, Label-free detection of protein interactions using deep UV fluorescence lifetime microscopy. ScienceDirect 367, 104-110 (2007)
- VALO Femtosecond Series -Aalto with SHG Option, https://hubner-photonics.com/products/lasers/femtosecond-lasers/valo-series/
by admin
Share
by admin
Share
STAY IN THE LOOP