以300飞秒的时间通道宽度进行FLIM
作者:Wolfgang Becker, V. Shcheslavskiy, Axel Bergmann Becker & Hickl GmbH
摘要:多年来,TCSPC FLIM的时间通道数为256个,时间通道宽度约为50 ps。随着更快探测器的引入,时间通道数增加到1024个,通道宽度减少到10 ps。最近,bh推出了IRF宽度低于20 ps的探测器。Nyquist准则表明,使用这些探测器的FLIM数据应以约2 ps的通道宽度记录。为了提取隐藏在探测器响应中的超快衰减组分,甚至更小的时间通道宽度都是有用的。在这里,我们报告了如何从时间通道宽度为300飞秒的FLIM数据中提取超快衰减组分。

-
TCSPC FLIM的时间通道宽度
多年来,TCSPC FLIM数据在时间轴上以256个时间通道的分辨率记录[1]。在12 ns的典型观测时间间隔内,256个时间通道的时间通道宽度约为50 ps。此时使用的探测器,如滨松H7422-40或滨松H5773和H5783,在峰值半宽(fwhm)下的IRF宽度分别约为300 ps和180 ps[1]。对于50个ps通道,这些探测器的仪器响应函数(IRF)被认为是充分采样的,以满足奈奎斯特标准。在奈奎斯特条件下,FLIM数据分析的结果不取决于IRF或荧光脉冲上升沿上数据点的相对位置。因此,更多的时间通道被认为是“空”分辨率,只浪费数据空间和数据分析时间。
随着bh HPM-100-40混合探测器的引入,要求发生了变化[1,2,3]。带有这些探测器的FLIM系统根据激发脉冲宽度提供100至140 ps的系统IRF(半高宽)。因此,bh采用了1024个时间通道的标准FLIM格式。10 ns记录间隔的时间通道宽度约为10 ps。这意味着IRF使用10个或更多数据点进行采样,并且再次满足奈奎斯特标准。当然,时间通道数量的四倍增加会导致数据大小的类似增加,从而导致FLIM数据处理时间的增加。因此,bh在数据分析软件中实现了GPU处理。GPU处理将数据分析速度提高了100倍,因此数据处理时间不再是一个问题[4]。
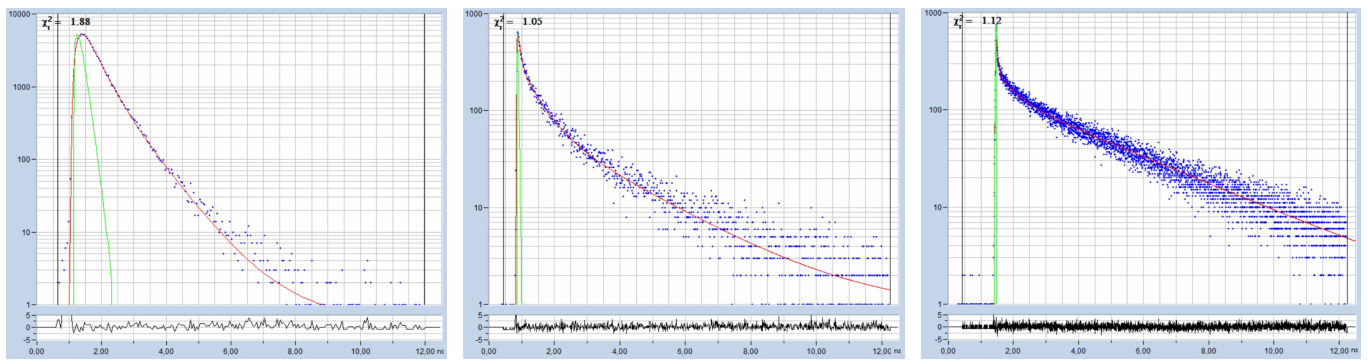
最近,BH公司推出了带有SPC-150NX和HPM-100-06探测器的FLIM系统[1,5]。在飞秒激光激发下,这些系统的IRF宽度小于20 ps,FWHM[6]。这意味着应使用2 ps或更小的时间通道宽度来满足奈奎斯特标准,并且时间通道的数量应增加到4096。可以反对的是,将光子分布在如此多的通道上会导致每个通道的光子数量减少,从而降低FLIM数据分析的准确性。然而,情况并非如此。寿命的信噪比与时间通道的数量无关,如[7]所示。它只取决于光子的总数。图1显示了使用不同FLIM数据格式记录的FLIM衰减轨迹的三个示例。
图片1具有不同时间通道宽度的FLIM数据的衰减曲线。从左到右:50ps、12ps和2.4ps。记录时间间隔12.5ns。红色曲线适用于三组分模型。(来自不同样本的数据)2 ps量级的时间通道宽度不会对bh TCSPC/FLIM模块造成问题,甚至可以通过早期TCSPC模块(如SPC-830)实现。然而,仅仅用足够的数据点覆盖IRF宽度并不是全部。高分辨率FLIM系统可用于提取寿命短于IRF宽度的超快荧光寿命组分。这种荧光寿命组分比通常认为的更频繁。我们在蘑菇孢子、植物组织、哺乳动物毛发和恶性黑色素瘤中发现了它们[8,9,10]。这些组分的衰减时间可以低至7 ps,甚至更少。在这些情况下,不仅要对IRF,还要对衰减函数进行充分采样。因此,在这些情况下,应使用低于700 fs的时间通道宽度。该范围内的通道宽度可从SPC-180NX、SPC180NXX以及等效的SPC-150NX和-NXX版本获得[1]。
时间通道宽度对快速衰减寿命组分分辨率的影响
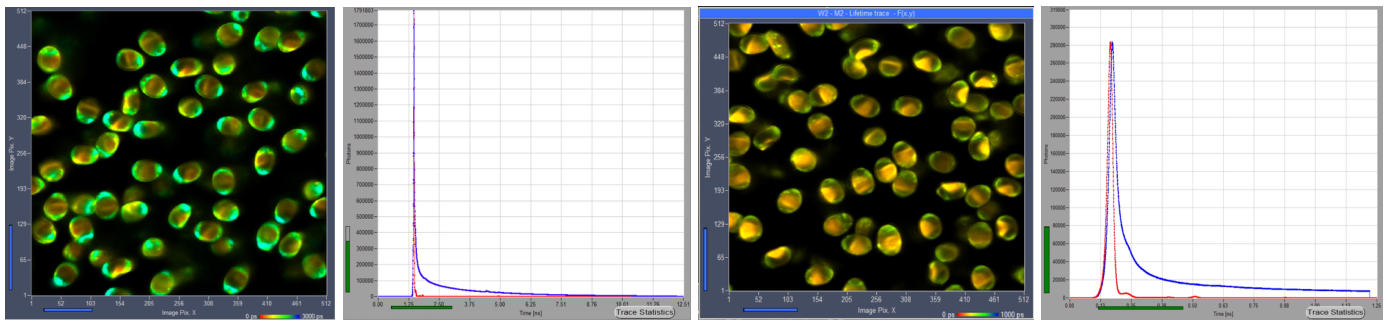
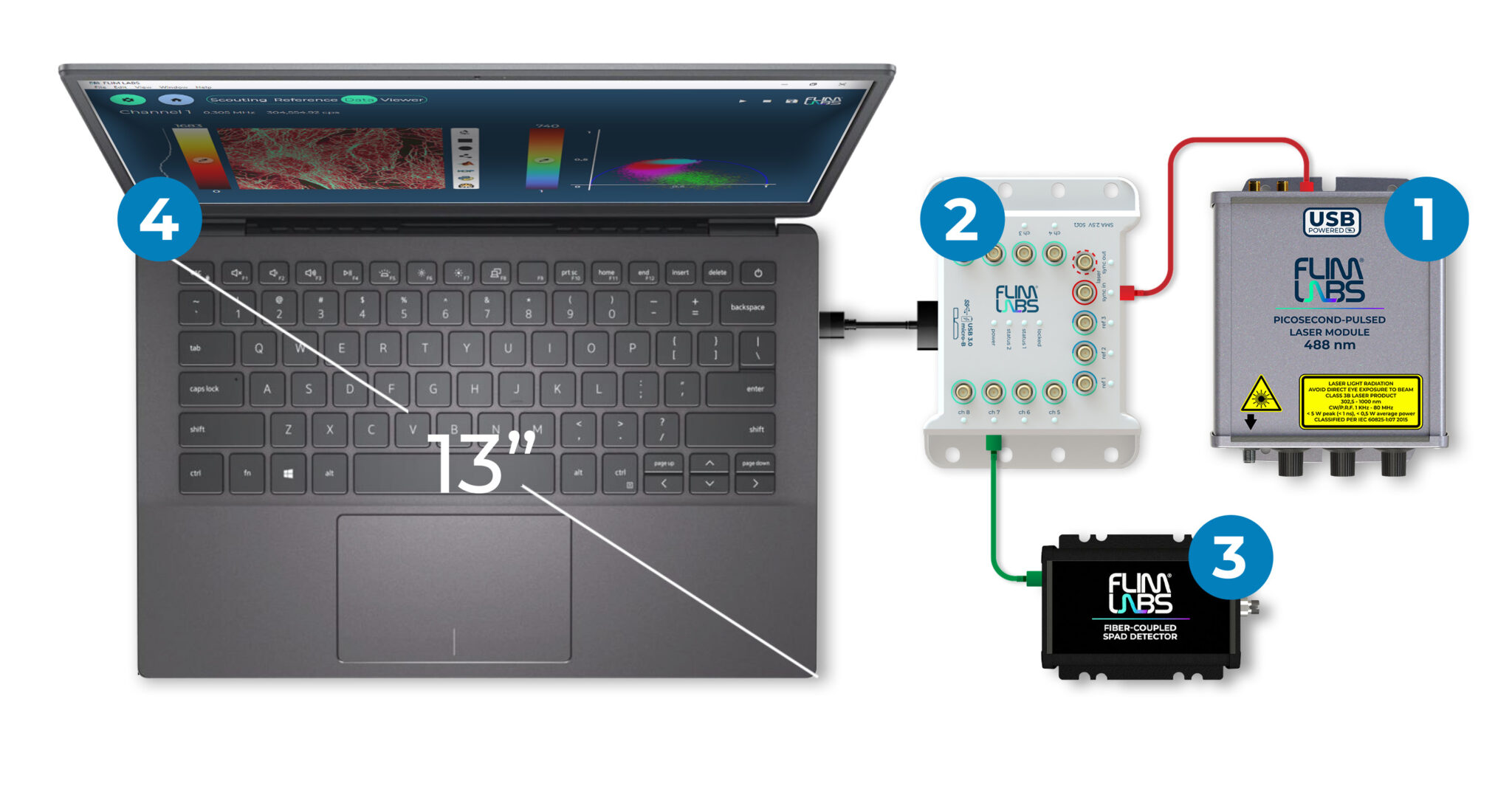
为了证明不同时间通道宽度对快速衰减寿命组分分辨率的影响,我们使用DCS-120 MP光纤激光多光子系统记录了蘑菇孢子(mushroom spores)的寿命图像[6]。探测器是HPM-100-06模块,TCSPC模块是SPC180NXX。用780nm激发波长的双光子图像采集了卷边网褶菌孢子(spores of Paxillus involutus),并用细糖粉的SHG倍频图像记录了IRF。所有数据均通过非解扫描检测光路记录。散射的激光被Chroma SP680滤光片滤除。用于FLIM记录的发射滤光片是450纳米长波通滤光片。为了记录IRF,滤光片被取出。以3ps和300fs的时间通道宽度记录荧光图像和SHG倍频图像对。两个实例的时间通道总数均为4096个,涵盖的观察时间间隔分别为12.5ns和1.25ns。SPCM数据采集软件的原始数据如图2所示。在数据中可以清楚地看到一个超快衰减寿命组分。
(Paxillus involutus spores卷边网褶菌孢子,SPCM中的原始数据。图像、衰减曲线(蓝色)和红外光谱(红色)、3 ps/通道和300 fs/通道。通过SPCM数据采集软件的在线显示功能显示,线性刻度。 )
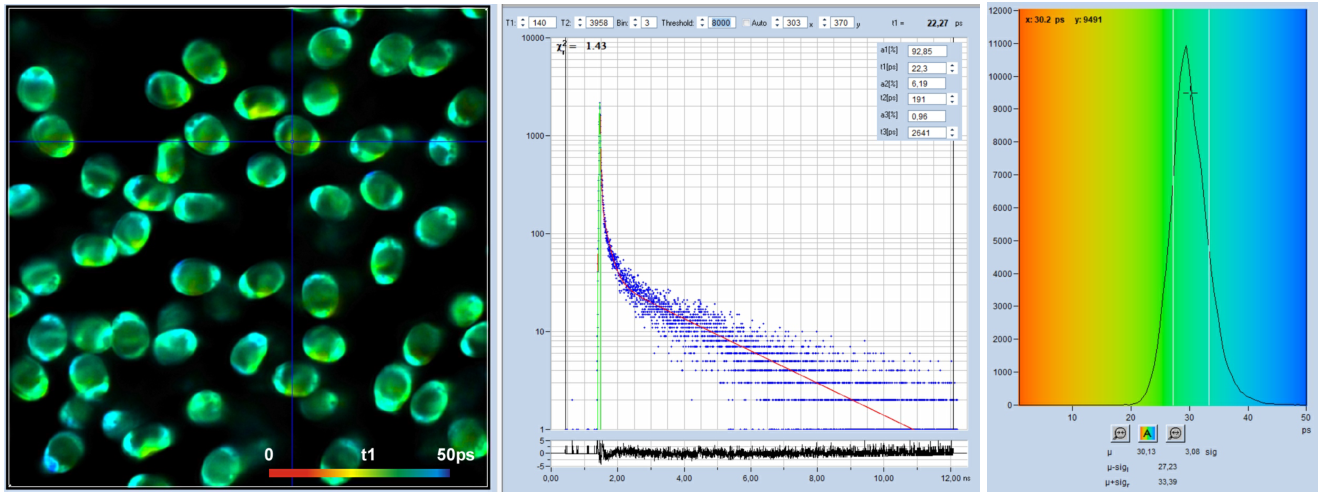
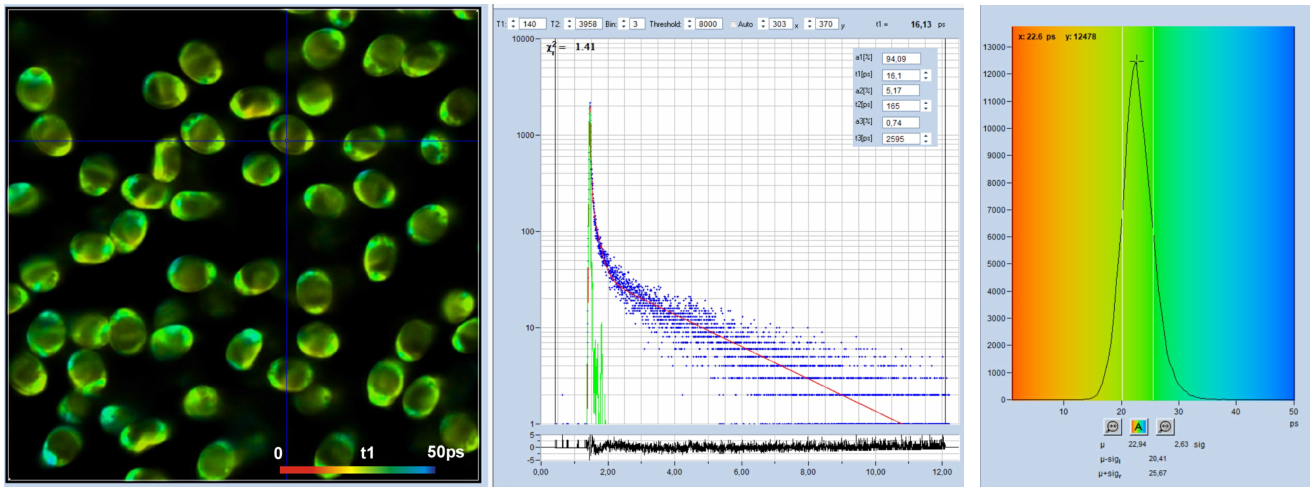
精确FLIM分析由bh SPCImage NG FLIM数据分析软件[1,4]执行。在所有情况下,对数据进行了三指数衰减分析。用3ps通道宽度记录的数据如图3所示。在左边显示最快衰减分量T1的图像,在光标位置中间的衰减曲线。“衰减”窗口中的插入显示衰减组件的振幅和寿命。图像所有像素的t1值直方图显示在右侧。
图3:Spores of Paxillus involutus卷边网褶菌孢子,时间通道宽度3ps,4096个时间通道,观察时间间隔12.5ns。从左到右:最快衰减寿命组分的图像,t1,光标位置的衰减曲线(蓝色)和IRF(绿色),图像像素上t1值的直方图。SPCImage NG的自动IRF。
从图中可以看出,衰减曲线数据得到了很好的拟合。如t1图像和直方图所示,快速衰减寿命组分t1的寿命是在高信噪比下获得的。t1的最常见值约为30 ps。
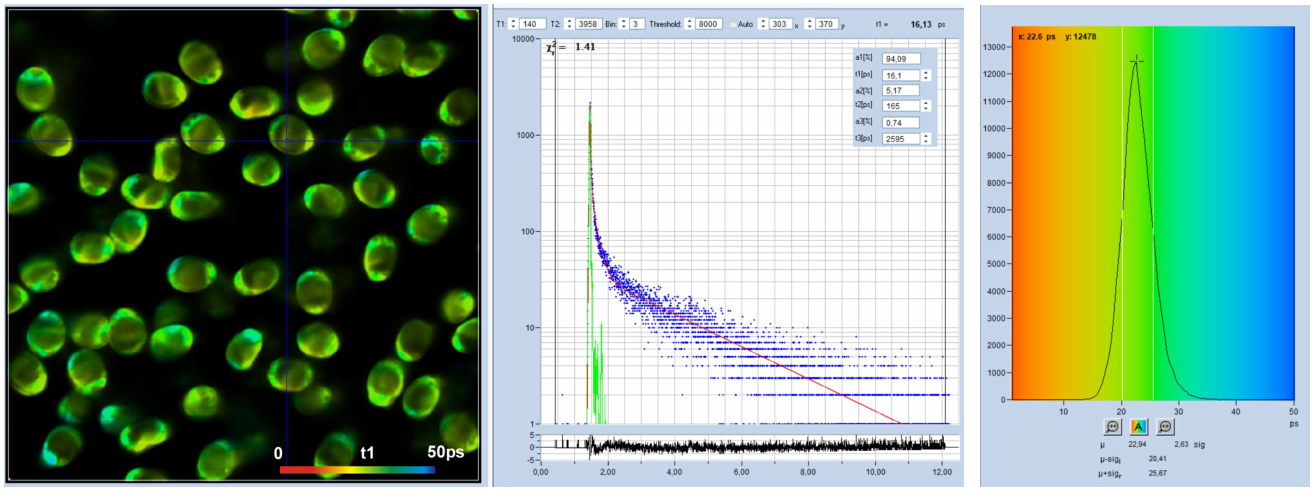
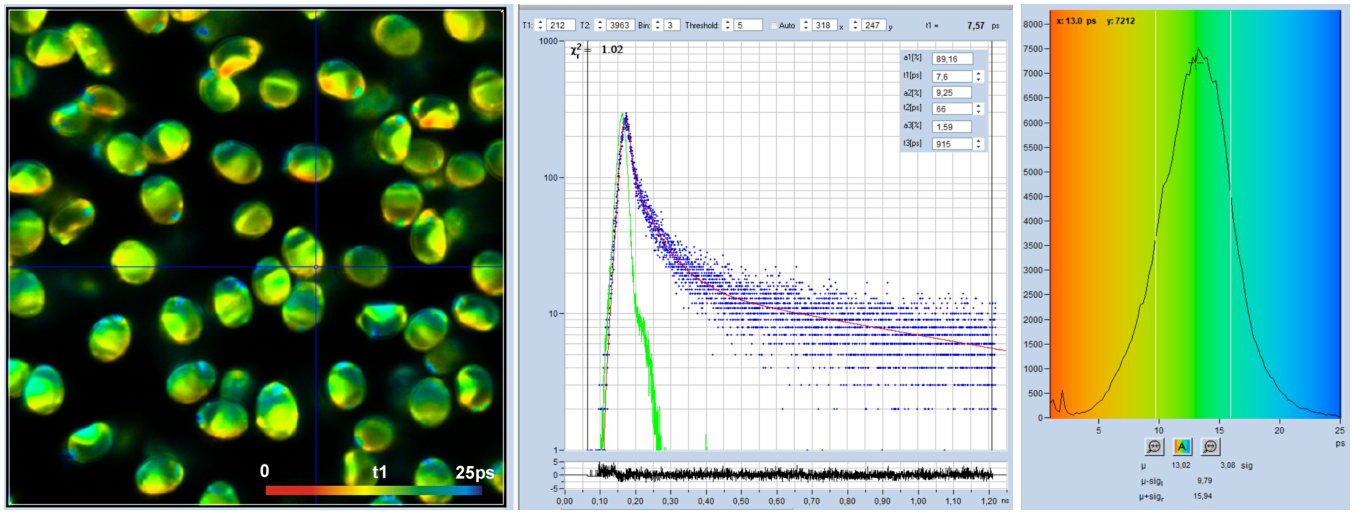
对于上面所示的分析,使用了SPCimage的“auto”IRF,请参阅[1],章节“SPCimage NG数据分析软件”。经验表明,对于极快的衰减,“自动”IRF通常有点太短。因此,我们用真实(测量)的IRF分析了相同的数据。结果如图4所示。图中显示,衰变的一般成分保持不变,不同的是t1变短了一点。然而,考虑到寿命仅为25 ps,差异并不显著。然而,对飞秒时间通道宽度的进一步数据的分析是使用真实的IRF进行的。
(图4:与图3相同,但使用真实IRF进行分析。)图5展示了以300飞秒的时间通道宽度记录的数据,即以比图3和图4快10倍的时间尺度记录的数据。时间通道数为4096,总观测时间间隔为1.25ns。在一个选定的点的衰减曲线数据显示在中间。绿色曲线是IRF,蓝色圆点是时间通道中的光子数。IRF是真实的,由糖粉记录。在使用的时间尺度上,IRF的半高宽扩展到70多个数据点。该图类似于传统时间分辨光谱仪的衰减曲线/IRF图,不同之处在于时间尺度快了20倍。由于将数据分解为如此高的多个数据点,反卷积程序能够确定比IRF宽度短得多的寿命分量。在图5所示的数据中,3-ps数据的快速衰减寿命组分t1被分成两部分,t1约为13 ps,低振幅分量t2约为60 ps。t1的分布如图5右侧的直方图所示。
(图5:Spores of Paxillus involutus,时间通道宽度300 fs,4096个时间通道,观察时间间隔1.25 ns。左:快速衰减寿命组分t1的图像,色阶为0到25 ps。中:衰减曲线(蓝色)、IRF(绿色)和光标位置处的衰减参数。右:图像像素上t1值的直方图。 )论述
上面显示的结果表明,带有-NXX版本bh TCSPC/FLIM模块和HPM-100-06探测器的FLIM系统能够分辨低于10ps范围内的衰减寿命组分。然而,这并不意味着在超快衰减域中的测量是直接的。一个常见的问题是显微镜NDD光束路径中的反射。为了收集从样品中散射出去的光子,透镜将显微镜透镜的图像投射到探测器上。通常甚至使用两步投射:第一个透镜将显微镜透镜的图像投射到探测器前面的第二个透镜上。第二透镜将第一透镜的图像投射到探测器的感光区域上。这种设计的优点是,光束的直径可以保持较小,并且可以在光束的大致平行部分放置滤光片。然而,该原理容易发生光学反射。在探测器或另一个光学表面反射的光子可能会投射回另一个表面,第二次反射,并在大约10或100 ps后反馈回探测器。结果是衰变曲线中出现了丑陋的反射。在具有高振幅超快衰减寿命组分的数据中,衰减曲线的峰值和后期之间的高强度比加剧了问题。在DCS-120MP系统的NDD光路中,通过仔细选择透镜曲率来避免透镜表面的准直反射,解决了该问题。
此外,非解扫描光学元件的设计并不能自动保证所有角度的光束和整个光圈的光程长度是恒定的。
最关键的元素是探测器前面的透镜。这种透镜焦距短,直径大。因此它有大量的球差。这意味着从边缘和中心进入透镜的光线具有不同的有效光程长度和不同的传输时间。这些差异可能只有几皮秒。在我们的系统中,这种效应导致IRF宽度略有增加,从自由光束的18到19 ps半高宽,到NDD光束路径的约23 ps半高宽。在第一近似下,荧光测量和IRF测量的展宽是相同的。因此,它对结果几乎没有影响。然而,如果样品没有正确聚焦或更换显微镜镜头,可能会发生变化。在这些情况下,光束横截面上的强度分布以及因此而产生的渡越时间分布会发生变化。
另一个潜在问题与IRF测量有关。除了通过SHG过程测量IRF之外,没有其他方法。乍一看,这似乎是一个理想的解决方案。倍频(在系统分辨率范围内)无限快,并以高强度发射。因此,可能的荧光污染对结果几乎没有影响。然而,有一个问题。倍频是正向发射的。通常情况下,样品内部的足够光会散射回检测光路。然而,留在样品背面的光可以反射或散射回来,并传输到探测器。反射光到达时会延迟,因此会使记录的IRF变宽,或导致令人讨厌的二次脉冲。因此,用吸收性覆盖物覆盖样品背面非常重要。但即便如此,信号的未知部分也可以从封面上恢复过来。考虑到正向发射比反向发射强得多,不能完全排除对记录的IRF形状的影响。总之,在记录超高分辨率FLIM数据时,建议注意光学细节。
参考文献:
- W. Becker, The bh TCSPC Handbook, 9th ed. (2021). Available at www.becker.hickl.com. Printed copies available from bh.
- Becker & Hickl GmbH, The HPM-100-40 Hybrid Detector. Application note, available on www.becker-hickl.com
- W. Becker, B. Su, K. Weisshart, O. Holub, FLIM and FCS Detection in Laser-Scanning Microscopes: Increased Efficiency by GaAsP Hybrid Detectors. Micr. Res. Tech. 74, 804-811 (2011)
- Becker & Hickl GmbH, SPCImage NG next generation FLIM data analysis software. Overview brochure, available on www.becker-hickl.com
- Becker & Hickl GmbH, Sub-20ps IRF Width from Hybrid Detectors and MCP-PMTs. Application note, available on www.becker-hickl.com
- Becker & Hickl GmbH, Two-Photon FLIM with a Femtosecond Fibre Laser. Application note, available on www.becker-hickl.com
- W. Becker, Bigger and Better Photons: The Road to Great FLIM Results. Education brochure, available on www.becker-hickl.com.
- W. Becker, C. Junghans, A. Bergmann, Two-Photon FLIM of Mushroom Spores Reveals Ultra-Fast Decay Component. Application note (2021), available on www.becker-hickl.com
- W. Becker, T. Saeb-Gilani, C. Junghans, Two-Photon FLIM of Pollen Grains Reveals Ultra-Fast Decay Component. Application note (2021), available on www.becker-hickl.com
- W. Becker, V. Shcheslavskiy, C. Junghans, T. Saeb-Gilani, A. Bergmann, O. Garanina, V. Elagin, Ultra-Fast Fluorescence Decay in Biological Material. Presentation at 19th AIM workshop, Berkeley (2022). Video available on www.becker-hickl.com.
by admin
Share
by admin
Share
STAY IN THE LOOP