移动细菌的无标签多光子FLIM
Wolfgang Becker, Axel Bergmann, Julius Heitz, Becker & Hickl GmbH, Berlin, Germany
摘要:活细菌通常很难在自然环境中成像,因为它们极易移动。为了获得合理的图像质量,必须使用极短的图像采集时间,然而,这导致像素光子数不足以进行精确的寿命分析。更高的激发功率并不能解决这个问题,因为它会损害细菌的生存能力,甚至导致严重的光损伤。因此,我们开发了一种技术,可以记录一系列快速单帧图像,通过相量分析识别这些图像中的细菌,并将相应像素的光子组合成高光子数的单个衰减曲线。该曲线通过时域中的多指数衰减分析进行处理,得到细菌的精确多指数衰减参数。
自体荧光FLIM
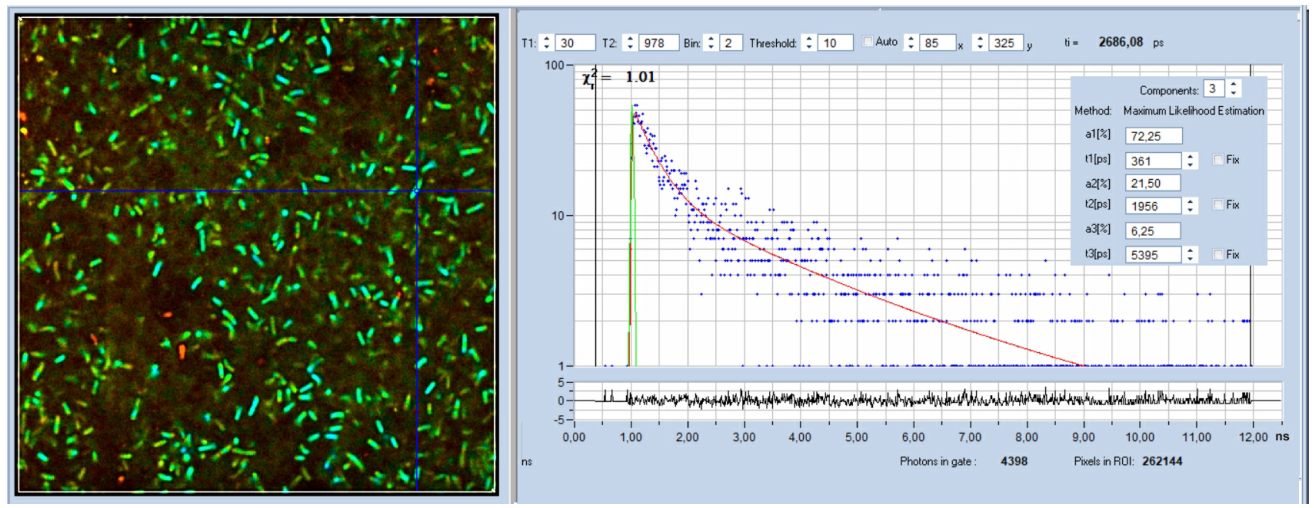
生物材料含有许多可用于荧光成像的荧光化合物。最有趣的是NAD(P)H(烟酰胺腺嘌呤(吡啶)二核苷酸)。NAD(P)H不仅参与细胞的代谢,其荧光还取决于代谢的类型。这种效应很难通过光谱成像看到,但可以通过FLIM可靠地解决。然后,它通过不同数量的快速和缓慢衰减荧光来显示自己[1,13,18]。因此,NAD(P)H FLIM-或NAD(P)H FLIM与FAD FLIM结合-也称为“代谢FLIM”[5,6]。它被用于大量生命科学应用[11,12,15,17,19]。有关文献概述,请参见[1]。唾液链球菌的FLIM图像如图所示。1。寿命衰减曲线显示了NAD(P)H的典型多指数行为。快速成分的衰减时间为361ps,来自游离NAD(P)H。慢荧光分为1.96ns和5.395ns两个组分,来自结合的NADPH和结合的NADH[10]。
图1:唾液链球菌的NADH FLIM图像。bh DCS-120 MP FLIM系统,激发波长为785 nm,检测波长为440 nm至480 nm。右侧显示了光标位置处的衰减曲线和衰减参数。
NAD(P)H成像需要340至380nm的激发波长。如此短的波长在显微镜下很难处理。光学系统的传输远不理想,并且存在较大的像差,从而影响空间分辨率。因此,通常采用双光子激发进行NAD(P)H 的FLIM成像。此外,代谢FLIM必须在代谢完整的活细胞和组织上进行。因此,适用的激发功率非常有限,并且荧光强度低。原则上,这对于bh的TCSPC FLIM[1,2]来说是没有问题的。该技术的时序稳定性如此之高,以至于从技术上来说,采集时间实际上是无限的。因此,通过简单地延长获取时间,总是可以获取足够数量的光子。对于中等寿命精度和低像素数,典型的采集时间在10秒到几分钟之间。这不是很长,但如果样本中感兴趣的对象正在移动,可能会导致问题。
问题
实时样本中的运动是任何FLIM用户的噩梦。为了获取足够的光子进行精确的衰变分析,必须累积大量的帧。只要样本中的对象在整个采集时间内保持原位,这就没有问题。然而,如果被调查的物体像细菌一样在移动,图像就会被抹去,细菌的衰变数据会与来自底物的信号混合。在这些情况下,第一个想法通常是提高激发功率,从而增加光子通量。然后将在更短的采集时间内达到衰减数据的给定精度。不幸的是,这种方法的选择非常有限。高激发功率很快会对样品造成侵入性影响,甚至造成灾难性损伤,使FLIM结果变得无用。这在细胞发射微弱的自体荧光实验中尤其如此。
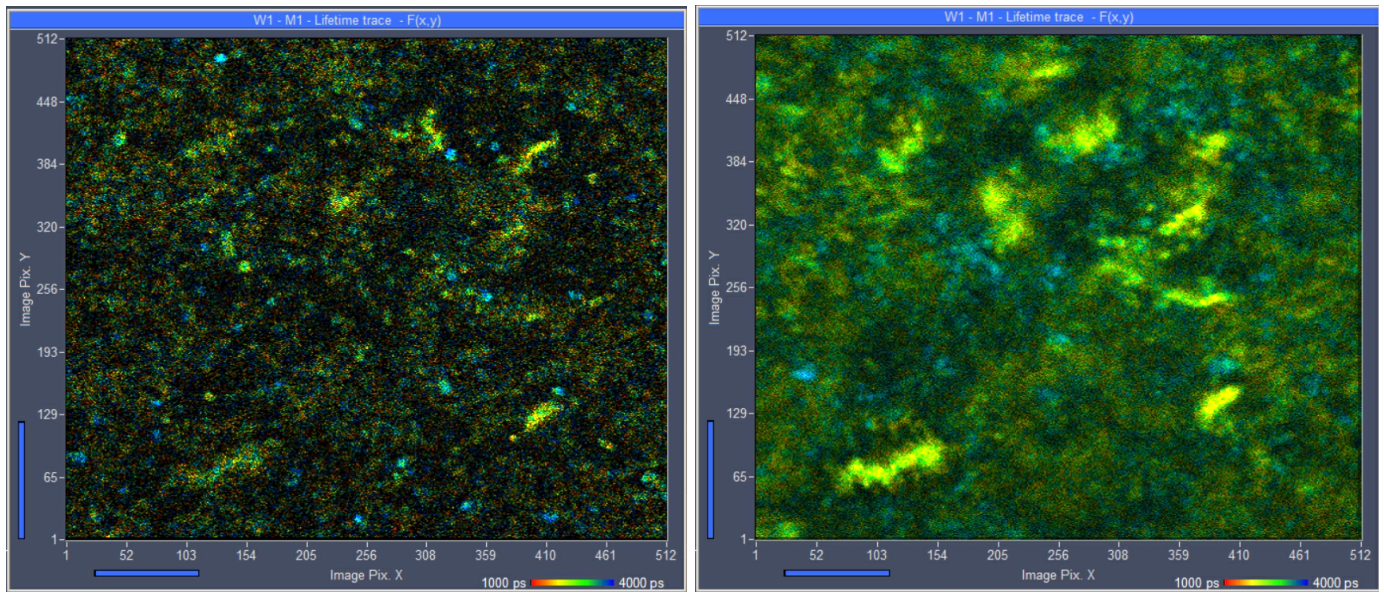
一个例子如图所示。2.图像显示了培养的底物上的活大肠杆菌。数据用bh DCS-120 MP光纤激光系统在785 nm激发波长下记录。细菌极易移动。在1.5秒的采集时间记录下,细菌仍然在边缘可见(左图)。然而,像素中的光子数不足以进行多指数衰减分析。图2中显示的另一个问题是底物的背景荧光。对于不动物体,它受到双光子激发过程的深度分辨率的抑制。然而,对于在采集期间移动的物体,背景的荧光与物体的荧光混合。
图2:左:大肠杆菌细菌培养,1.5秒持续时间的单次扫描。细菌几乎是可见的,但没有足够的光子进行精确的寿命分析。右:相同的样本,采集时间为24秒。每个像素有足够的光子,但运动使细菌不可见。
随着采集时间增加到24秒(图2,右侧),运动完全模糊了图像细节。只有不动的细菌仍然可见。这些细菌的寿命异常长。它们可能不是可行的,因此不值得进一步调查。
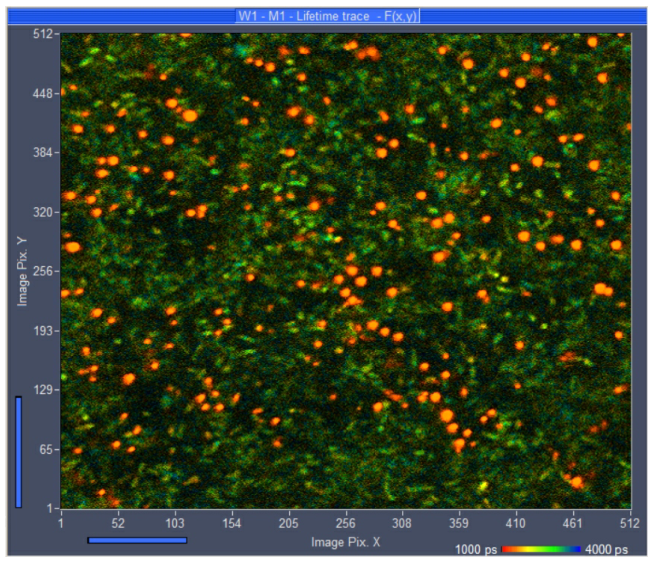
如上所述,通常试图通过更高的激发功率来解决该问题。当然,更高的激发功率产生更高的荧光光子速率,从而在更短的时间内产生更好的图像。但这是有代价的。图3显示了激发功率增加2.5倍的记录。这导致光子速率增加6.52倍。毫无疑问,细菌比图中更清晰可见。2,但出现了大量寿命极短的斑点(图中为红色)。这些是烧伤痕迹,表明发生了严重的光损伤。当然,仍然有细菌看起来完好无损。然而,由于附近存在严重的光损伤,寿命衰减数据,尤其是从它们获得的代谢信息是不可信的。
图3:激光功率增加2.5倍时的FLIM记录。超短寿命的红色斑点表明样品损坏。SPCM的在线寿命显示,红色到蓝色=1 ns到4 ns。
图2和图3所示的问题导致了对更快FLIM技术的需求雪崩。这些解决方案被设计为在高光子通量下工作,但以牺牲光子效率为代价[4,14]。当然,该方法并不成功,导致FLIM不是一种适合分子成像的技术。当然,这是错误的。错误在哪里?
采集速度的限制在于样品传递高光子速率的能力,而不是FLIM技术的计数能力。以光子效率为代价增加计数能力会使情况变得更糟。需要更多的光子才能达到给定的精度水平,其结果是损伤效应变得更加严重。除非样品非常明亮和稳定(在分子成像应用中并非如此[1]),否则TCSPC FLIM是并且仍然是最快的技术,因为它比“快速”FLIM技术需要更少的光子。
解决方案
基于相量图的图像分割
那么,如何解决样本中的运动问题呢?显然,不是使用更快的FLIM技术。从移动细菌中获取衰变信息的一种可能方法是记录一次快速扫描,识别图像中的细菌,并汇总位于细菌内部的所有像素的寿命衰减数据。
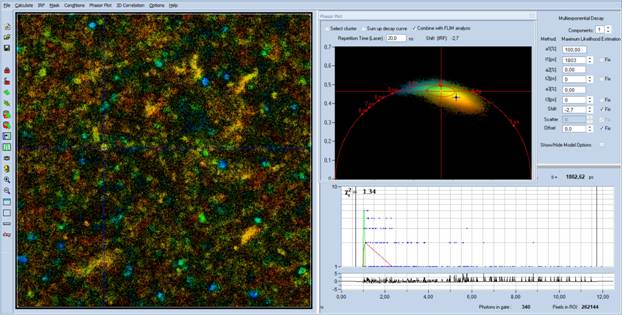
如何在一次扫描的图像中识别细菌?一种简单(且容易获得)的方法是bh的SPCImage NG FLIM数据分析的相量图,请参见[1,7,9]。相量图对像素中衰减数据特征的差异非常敏感。具有相似衰减特征的像素在相量图中彼此靠近。即使光子数对于逐像素分析来说太低,细菌的相量范围也可以被识别。然后,操作员标记感兴趣的相量范围,并在图像中对相应的像素进行反向注释。将这些像素中的衰减数据相加,并通过正常时域拟合程序分析所得曲线。
该过程如图4所示。左侧显示了一幅单帧图像。正如预期的那样,标准的寿命分析无法提供细菌的精确荧光寿命衰减数据,请参见右下角的寿命衰减数据。然而,SPCImage NG的最大似然拟合在图像中提供了近似的寿命(以颜色表示)。相量图(右上)显示了扫描各个像素的相量值云。选择与细菌颜色相同的一系列相量(比较左侧的FLIM图像)选择细菌内部的像素。
by admin
Share
by admin
Share
STAY IN THE LOOP
Subscribe to our free newsletter.
ID Quantique (IDQ) 成为 IonQ 的子公司,支持全球联合业务增长努力和战略合作伙伴关系 此 […]
有时,浏览产品线并找到适合您的产品可能很困难。如果您正在寻找通信波段单光子探测解决方案,ID Quantiqu […]
IDQube近红外单光子探测器是一种经济高效的解决方案,提供精确可靠的单光子检测,具有高探测效率、精确的定时抖 […]